题目内容
A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A是元素周期表中原子半径最小的元素,B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物.请回答:
(1)写出元素的符号:C ;E .
(2)化合物A2D2的电子式为 .
(3)元素B的一种同位素可测定文物年代,这种同位素的符号是 .
(4)B的最高价氧化物的结构式 .
(5)A和C形成的化合物与D单质的反应是重要的工业反应,写出反应方程式 .
(1)写出元素的符号:C
(2)化合物A2D2的电子式为
(3)元素B的一种同位素可测定文物年代,这种同位素的符号是
(4)B的最高价氧化物的结构式
(5)A和C形成的化合物与D单质的反应是重要的工业反应,写出反应方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A是元素周期表中原子半径最小的元素,故A是H;B元素原子L层上的电子数为K层电子数的2倍,则B原子L层电子数为4,所以B为C元素;元素D的2价阴离子的核外电子排布与氖原子相同,则D为O元素;C的原子序数介于碳元素与氧元素之间,所以C为N元素;A与E同主族,原子序数A<E,A和E这两种元素与D都能形成X2Y、X2Y2型化合物,则A为H元素,E为Na元素,据此解答各小题即可.
解答:
解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大.A是元素周期表中原子半径最小的元素,故A是H;B元素原子L层上的电子数为K层电子数的2倍,则B原子L层电子数为4,所以B为C元素;元素D的2价阴离子的核外电子排布与氖原子相同,则D为O元素;C的原子序数介于碳元素与氧元素之间,所以C为N元素;A与E同主族,原子序数A<E,A和E这两种元素与D都能形成X2Y、X2Y2型化合物,则A为H元素,E为Na元素,
依据分析可知:A为H,B为C,C为N,D为O,E为Na;
(1)根据分析可知,C为N,E为Na,
故答案为:N;Na;
(2)化合物A2D2是H2O2,属于共价化合物,分子中氧原子之间形成1对共用电子对、氢原子与氧原子之间形成1对共用电子对,电子式为: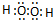 ,
,
故答案为: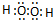 ;
;
(3)元素B为C元素,C的一种同位素C-14可测定文物年代,这种同位素的符号为: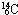 ,
,
故答案为: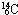 ;
;
(4)元素B为C元素,C的最高价氧化物为二氧化碳,二氧化碳中C与O形成两对共用电子对,用短线代替共用电子对即为结构式,二氧化碳的结构式为:O=C=O,
故答案为:O=C=O;
(5)NH3与过量O2在催化剂、加热条件下发生反应生成一氧化氮和水,反应方程为:4NH3+5O2
4NO+6H2O,
故答案为:4NH3+5O2
4NO+6H2O.
依据分析可知:A为H,B为C,C为N,D为O,E为Na;
(1)根据分析可知,C为N,E为Na,
故答案为:N;Na;
(2)化合物A2D2是H2O2,属于共价化合物,分子中氧原子之间形成1对共用电子对、氢原子与氧原子之间形成1对共用电子对,电子式为:
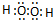 ,
,故答案为:
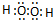 ;
;(3)元素B为C元素,C的一种同位素C-14可测定文物年代,这种同位素的符号为:
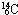 ,
,故答案为:
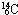 ;
;(4)元素B为C元素,C的最高价氧化物为二氧化碳,二氧化碳中C与O形成两对共用电子对,用短线代替共用电子对即为结构式,二氧化碳的结构式为:O=C=O,
故答案为:O=C=O;
(5)NH3与过量O2在催化剂、加热条件下发生反应生成一氧化氮和水,反应方程为:4NH3+5O2
| ||
| △ |
故答案为:4NH3+5O2
| ||
| △ |
点评:本题考查了位置、结构与性质的关系,题目难度中等,根据题干信息正确推断各元素名称为解答关键,注意掌握元素周期表中各元素位置、结构与性质的关系,明确元素周期律、元素周期表的内容,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法正确的是( )
| A、X、M的原子能形成两种阴阳离子数目之比都为1:2的离子化合物 |
| B、由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| C、元素Y、Z、W的单质晶体属于同种类型的晶体 |
| D、元素W和M均有多种单质 |
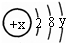 试回答:
试回答: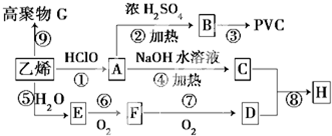
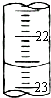 为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验:
为了测定某NaOH样品中NaOH的质量分数(杂质不参与反应),某化学兴趣小组进行了如下实验: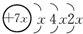 ,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个未成对电子,E的外围电子排布式为3d64s2.回答下列问题: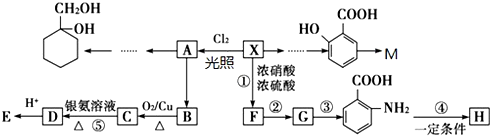
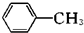
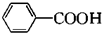
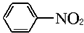
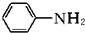 (苯胺,易被氧化)
(苯胺,易被氧化)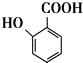 生成高分子化合物M的化学方程式:
生成高分子化合物M的化学方程式: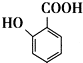 有多种同分异构体,其中含有1个醛基和1个羟基的芳香族化合物有
有多种同分异构体,其中含有1个醛基和1个羟基的芳香族化合物有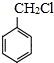 和其他无机化合物合成
和其他无机化合物合成 最合理步骤的反应类型依次是:
最合理步骤的反应类型依次是: