题目内容
15.下列说法正确的是( )| A. | 离子键就是阴、阳离子间的静电引力 | |
| B. | 所有金属元素与所有非金属元素间都能形成离子键 | |
| C. | NH4Cl属于离子化合物 | |
| D. | 在离子化合物CaCl2中,两个氯离子间也存在离子键 |
分析 A.离子键为阴、阳离子间的静电引力和静电斥力;
B.氯化铝为共价化合物;
C.氯化铵中含有铵根离子和氯离子,属于离子化合物;
D.氯化钙中,两个氯离子之间不存在离子键.
解答 解:A.离子键为阴阳离子之间的相互作用力,包括静电引力、静电斥力,故A错误;
B.金属元素与所有非金属元素之间不一定形成离子化合物,如Al与Cl形成的氯化铝为共价化合物,故B错误;
C.NH4Cl中含有铵根离子与氯离子之间形成的离子键,为离子化合物,故C正确;
D.离子化合物CaCl2中,两个氯离子与钙离子之间存在离子键,而两个氯离子之间不存在离子键,故D错误;
故选C.
点评 本题考查了离子化合物结构与性质,题目难度不大,明确化合物类型与化学键之间的关系为解答关键,注意离子键既包括静电引力,也包括静电斥力,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
2.下列关于反应“化合物甲+单质A$\stackrel{一定条件}{→}$化合物乙+单质B”的说法正确的是( )
| A. | 反应在水溶液中进行时,若A为金属,则B一定是金属 | |
| B. | 反应在水溶液中进行时,若A为非金属,则B一定是非金属 | |
| C. | 反应在加热或高温下进行时,若A为金属,则B一定是非金属 | |
| D. | 反应在加热或高温下进行时,若A为非金属,则B一定是金属 |
10.阿司匹林是日常生活中应用广泛的医药之一,它可由下列方法合成:
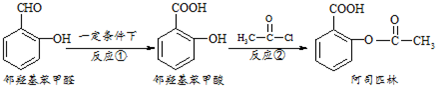
下列说法正确的是( )

下列说法正确的是( )
| A. | 与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有3 种 | |
| B. | 用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应① | |
| C. | 邻羟基苯甲醛不能和溴水发生取代反应 | |
| D. | 1mol阿司匹林最多可以和2molNaOH反应 |
20.某有机物的蒸气完全燃烧时,需要三倍于其体积的O2,产生二倍于其体积的CO2,则该有机物可能是(体积在同温同压下测定)( )
| A. | C2H6 | B. | CH3COOH | C. | CH3CH2OH | D. | CH2OHCH2OH |
7.元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm)
(1)A和E两元素组成的化合物的电子式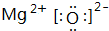 .
.
(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式)
(4)C和E形成的化合物中具有还原性的是SO2(填化学式).
(5)A和D所形成化合物的晶体类型:离子晶体.
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
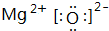 .
.(2)B的最高价氧化物的水化物与C的最高价氧化物的水化物反应的离子方程式为:Al(OH)3+3H+=Al3+3H2O
(3)上述五种元素的最高价氧化物对应水化物的酸性最强的是HClO4(填化学式)
(4)C和E形成的化合物中具有还原性的是SO2(填化学式).
(5)A和D所形成化合物的晶体类型:离子晶体.
4.下列既属于吸热反应,又属于氧化还原反应的是( )
| A. | 钠与冷水反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 铝与氧化铁的反应 |
 ;(2)NaOH
;(2)NaOH ;(3)HClO
;(3)HClO ;(4)H2O2
;(4)H2O2 .
.
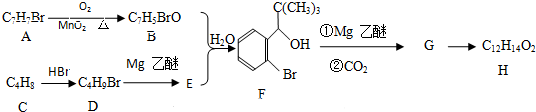
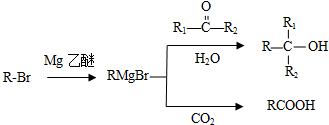
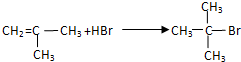 ;G→H
;G→H .
.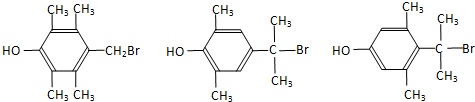 .
.