题目内容
硫酸亚铁铵又称莫尔盐,是浅绿色晶体.它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂.某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度.
已知:①
②莫尔盐在乙醇溶剂中难溶.
Ⅰ.莫尔盐的制取
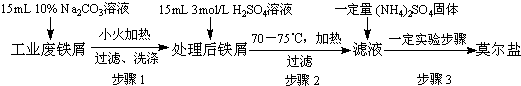
试分析:
(1)步骤2中加热方式 (填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是 .
(2)步骤3中包含的实验操作名称 .
(3)产品莫尔盐最后用 洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4?FeSO4?6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液用0.1000mol?L-1的酸性KMnO4溶液分三次进行滴定.
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如图实验.

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为 ,验证推测的方法为: .
(丙)方案三:(通过NH4+测定)实验设计图如图所示.取20.00mL硫酸亚铁铵溶液进行该实验.
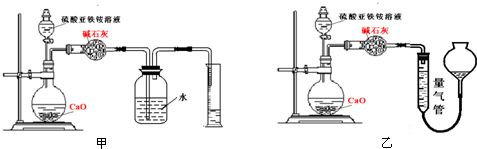
(2)①装置 (填“甲”或“乙”)较为合理,判断理由是 .量气管中最佳试剂是 (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为 .
已知:①
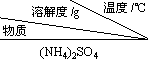 | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4?FeSO4?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式
(2)步骤3中包含的实验操作名称
(3)产品莫尔盐最后用
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4?FeSO4?6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液用0.1000mol?L-1的酸性KMnO4溶液分三次进行滴定.
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如图实验.

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为
(丙)方案三:(通过NH4+测定)实验设计图如图所示.取20.00mL硫酸亚铁铵溶液进行该实验.

(2)①装置
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为
考点:探究物质的组成或测量物质的含量,制备实验方案的设计
专题:实验设计题
分析:Ⅰ.(1)水浴加热便于控制温度;亚铁离子易被氧化,少量铁还原氧化生成的Fe3+;FeSO4在温度低时溶解度较小;
(2)从滤液到得到晶体需要加热浓缩、冷却结晶、过滤、洗涤干燥等过程;
(3)乙醇易挥发,少量酒精来洗去晶体表面杂质;
Ⅱ.(1)亚铁离子具有还原性,易被氧化;检验亚铁离子的氧化产物铁离子;
(2)①根据氨气的溶解性和装置特点分析;
②根据氨气的体积计算氨气的物质的量,根据N守恒计算出硫酸亚铁铵的质量,进而计算质量分数.
(2)从滤液到得到晶体需要加热浓缩、冷却结晶、过滤、洗涤干燥等过程;
(3)乙醇易挥发,少量酒精来洗去晶体表面杂质;
Ⅱ.(1)亚铁离子具有还原性,易被氧化;检验亚铁离子的氧化产物铁离子;
(2)①根据氨气的溶解性和装置特点分析;
②根据氨气的体积计算氨气的物质的量,根据N守恒计算出硫酸亚铁铵的质量,进而计算质量分数.
解答:
解:Ⅰ.(1)步骤二实验需要温度为:70~75℃,采用水浴加热便于控制温度;亚铁离子易被氧化,少量铁可还原氧化生成的Fe3+,减少产物中的Fe3+杂质,如果不趁热过滤就会有FeSO4?7H2O析出;
故答案为:水浴加热;防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出;
(2)从滤液到得到晶体需要加热浓缩、冷却结晶、过滤、洗涤干燥等过程,故答案为:加热浓缩、冷却结晶;
(3)乙醇易挥发,用少量酒精来洗去晶体表面杂质,用水会使摩尔盐溶解损失,用滤液会带入杂质,故答案为:b;
Ⅱ.(1)亚铁离子具有还原性,易被氧化成铁离子,故测得硫酸亚铁铵浓度偏小;可检验亚铁离子的氧化产物铁离子,具体操作为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
故答案为:Fe2+已被空气部分氧化;取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
(2)①氨气易溶于水,不能用排水法收集,甲装置中导管伸入液面下,易倒吸,用排水法,不合理;乙装置中导管在液面以上,符合排液体收集气体要求,量气管中液体应不能溶解氨气,氨气易溶于水和饱和碳酸钠溶液,难溶于四氯化碳,故用排四氯化碳法收集;
故答案为:乙;甲装置会出现倒吸;c;
②VL氨气的物质的量为:
=
mol,
m g硫酸亚铁铵样品中含N的物质的量为
×
mol=
mol,
硫酸亚铁铵的纯度为:
×100%=
×100%,
故答案为:
×100%.
故答案为:水浴加热;防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出;
(2)从滤液到得到晶体需要加热浓缩、冷却结晶、过滤、洗涤干燥等过程,故答案为:加热浓缩、冷却结晶;
(3)乙醇易挥发,用少量酒精来洗去晶体表面杂质,用水会使摩尔盐溶解损失,用滤液会带入杂质,故答案为:b;
Ⅱ.(1)亚铁离子具有还原性,易被氧化成铁离子,故测得硫酸亚铁铵浓度偏小;可检验亚铁离子的氧化产物铁离子,具体操作为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
故答案为:Fe2+已被空气部分氧化;取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化;
(2)①氨气易溶于水,不能用排水法收集,甲装置中导管伸入液面下,易倒吸,用排水法,不合理;乙装置中导管在液面以上,符合排液体收集气体要求,量气管中液体应不能溶解氨气,氨气易溶于水和饱和碳酸钠溶液,难溶于四氯化碳,故用排四氯化碳法收集;
故答案为:乙;甲装置会出现倒吸;c;
②VL氨气的物质的量为:
| VL |
| 22.4L/mol |
| V |
| 22.4 |
m g硫酸亚铁铵样品中含N的物质的量为
| 500mL |
| 20mL |
| V |
| 22.4 |
| 25V |
| 22.4 |
硫酸亚铁铵的纯度为:
| ||||
| mg |
| 392V×25 |
| 44.8m |
故答案为:
| 392V×25 |
| 44.8m |
点评:本题考查制备实验方案的设计,综合性较强,注意结合题给信息和装置特点及物质的性质分析.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 “诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图下列关于“诺龙”的说法中不正确的是( )
“诺龙”属于国际奥委会明确规定的违禁药品中合成代谢类的类固醇,其结构简式如图下列关于“诺龙”的说法中不正确的是( )| A、分子式是C18H26O2 |
| B、能在NaOH醇溶液中发生消去反应 |
| C、既能发生加成反应,也能发生酯化反应 |
| D、既能发生氧化反应,也能发生还原反应 |
12ml0.1mol/L的亚硫酸(H2SO3)溶液,恰好跟20ml浓度为0.02mol/L的重铬酸钾(K2Cr2O7)溶液完全反应,则元素铬(Cr)在还原产物中的化合价是( )
| A、+1 | B、+2 | C、+3 | D、+6 |
某温度下,在一个1L的密闭容器中,加人4molA和2molB进行如下反应:3A(g)+2B(g)?4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A、该反应的化学平衡常数表达式是K=
| ||
| B、此时,B的平衡转化率是35% | ||
| C、增大该体系的压强,平衡向右移动,化学平衡常数增大 | ||
| D、增加C,B的平衡转化率不变 |
