题目内容
10.请按指定要求完成下列问题.(1)在3BrF3+5H2O═HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被水所还原的BrF3的物质的量是$\frac{4}{3}$mol.
(2)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目
 .
.②若生成0.2mol AsH3,则转移的电子数为1.2NA.
(3)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4═2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为1:1;
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两方法中消耗的还原剂质量之比为73:34
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为Cl-,则相同质量的ClO2是Cl2消毒效率的2.63倍.
分析 (1)3BrF3+5H2O═HBrO3+Br2+9HF+O2中,Br元素的化合价分别由+3价升高为+5价、由+3价降低为0,O元素的化合价由-2价升高为0;
(2)As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中Zn元素的化合价升高,As元素的化合价降低,该反应转移电子为12e-;
(3)①2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中,NaClO3为氧化剂,HCl为还原剂,只有一半HCl作还原剂;
②得到相同条件下相同体积的ClO2气体,设均生成2mol,方法一中作还原剂的HCl为2mol,方法二中作还原剂的H2O2为1mol;
③设质量均为m,结合n=$\frac{m}{M}$及化合价变化计算.
解答 解:(1)3mol的BrF3参加反应时,有5mol水参加反应时,O元素化合价由-2价升高到0价,2mol水被氧化,失去4mol电子,Br元素化合价由+3价降低到0价,则由H2O还原的BrF3为$\frac{4mol}{(3-0)}$=$\frac{4}{3}$mol,故答案为:$\frac{4}{3}$mol;
(2)①As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O中Zn元素的化合价升高,As元素的化合价降低,该反应转移电子为12e-,用双线桥法标出电子转移的方向和数目为 ,故答案为:
,故答案为: ;
;
②若生成0.2mol AsH3,由As元素的化合价由+3价降低为-3价可知转移的电子数为0.2mol×6×NA=1.2NA,故答案为:1.2NA;
(3)①2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O中,NaClO3为氧化剂,HCl为还原剂,只有一半HCl作还原剂,由反应可知氧化剂与还原剂的物质的量之比为2mol:2mol=1:1,故答案为:1:1;
②得到相同条件下相同体积的ClO2气体,设均生成2mol,方法一中作还原剂的HCl为2mol,方法二中作还原剂的H2O2为1mol,可知两方法中消耗的还原剂质量之比为2mol×36.5g/mol:1mol×34g/mol=73:34,故答案为:73:34;
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为Cl-,则相同质量的ClO2是Cl2消毒效率的$\frac{\frac{m}{67.5}×5}{\frac{m}{71}×2×1}$=2.63倍,故答案为:2.63.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子转移计算、物质的量的有关计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案| A. | 硫酸铜溶液 | B. | 0.5mol•L-1盐酸 | C. | 0.5mol•L-1H2SO4 | D. | 自来水 |
| A. | 化合物电离时,生成的阴离子有氢氧根离子的是碱 | |
| B. | 在相同温度下,强电解质溶液一定比弱电解质溶液的导电性强 | |
| C. | 碱性氧化物都是金属氧化物,正盐中可能含有氢元素 | |
| D. | 向醋酸溶液中加入少量氢氧化钠溶液,因发生中和反应,溶液的导电能力降低 |
①甲醇 ②1-丙醇 ③1-丁醇 ④2-丁醇 ⑤2,2-二甲基-1-丙醇 ⑥2-戊醇 ⑦环己醇.
| A. | ①⑤ | B. | ②③④⑥⑦ | C. | ②③④⑥ | D. | ②③④ |
 在实验室里可用如图所示装置来制取氯酸钠、次氯酸钠和探究氯水的性质. 如图中:
在实验室里可用如图所示装置来制取氯酸钠、次氯酸钠和探究氯水的性质. 如图中:①为氯气发生装置;
②的试管里盛有15mL 30% NaOH溶液来制取氯酸钠,并置于热水浴中;
③的试管里盛有15mL 8% NaOH溶液来制取次氯酸钠,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过分液漏斗(填写仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有C(填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol•L-1的浓盐酸混合加热,充分反应后生成的氯气
小于 0.06mol.(填“大于”“小于”“等于”),若有17.4g的MnO2被还原,则被氧化的HCl质量为142g.
(3)比较制取氯酸钠和次氯酸钠的条件,二者的差异是①所用NaOH浓度不同;②反应控制的温度不同.
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写如表中的空白.
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | HClO有强氧化性,体现漂白作用是其褪色 |
| 然后溶液从无色逐渐变为溶液颜色变为浅绿色色 | 溶液中溶解了大量的氯气,体现浅绿色 |
| A. | 1.6 a g | B. | 3.2a g | C. | (a-3.2)g | D. | (a-1.6)g |
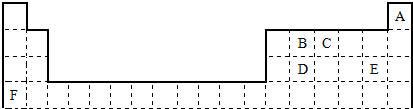
 .比较E、F的两种简单离子的半径大小:E-大于(填大于或小于)F+
.比较E、F的两种简单离子的半径大小:E-大于(填大于或小于)F+