题目内容
实验室也可用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O来快速制取氯气.
(1)请标出电子的转移方向和数目:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)若产生标准状况下Cl211.2L,则反应过程中转移的电子数为 ,被氧化的还原剂的物质的量为 .
(3)需消耗36.5%的浓盐酸多少质量?
(1)请标出电子的转移方向和数目:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)若产生标准状况下Cl211.2L,则反应过程中转移的电子数为
(3)需消耗36.5%的浓盐酸多少质量?
考点:氧化还原反应的计算
专题:氧化还原反应专题
分析:反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素化合价由+7价降低到+2价,Cl元素化合价由-1价升高到0价,结合化合价的变化判断电子转移的方向和数目,并结合相关反应的方程式计算.
解答:
解:(1)依据元素化合价变化升降数值,结合氧化还原反应的双线桥标出电子转移方向和数目;锰元素化合价从+7价降低到+2价;氯元素化合价从-1价升高为0价;双线桥表示为: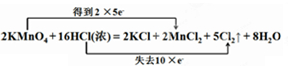 ,
,
故答案为: ;
;
(2)若产生标准状况下Cl211.2L,n(Cl2)=
=0.5mol,则转移电子1mol,电子数目为6.02×1023或NA,被氧化的HCl的物质的量为1mol,
故答案为:6.02×1023或NA;1mol;
(3)反应生成0.5mol氯气,由方程式可知需要1.6molHCl,质量为m(HCl)=1.6mol×36.5g/mol=58.4g,
则溶液的质量为
=106g,
答:需消耗36.5%的浓盐酸的质量为160g.
 ,
,故答案为:
 ;
;(2)若产生标准状况下Cl211.2L,n(Cl2)=
| 11.2L |
| 22.4L/mol |
故答案为:6.02×1023或NA;1mol;
(3)反应生成0.5mol氯气,由方程式可知需要1.6molHCl,质量为m(HCl)=1.6mol×36.5g/mol=58.4g,
则溶液的质量为
| 58.4g |
| 36.5% |
答:需消耗36.5%的浓盐酸的质量为160g.
点评:本题考查学生氧化还原反应的有关知识以及相关计算问题,侧重于学生的分析能力和计算能力的考查,为高频考点,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大,注意灵活应用.

练习册系列答案
相关题目
同周期的X、Y、Z三种元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
| A、原子半径:X>Y>Z |
| B、单质的非金属性:X<Y<Z |
| C、原子序数:X>Y>Z |
| D、气态氢化物稳定性:X<Y<Z |
下列反应需要加入氧化剂才能实现的( )
| A、SO2→SO32- |
| B、HCl→Cl2 |
| C、HCO3-→CO2↑ |
| D、Cl2→ClO- |

 ③
③
