题目内容
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K与温度t的关系如下:
请回答下列问题:(1)该反应的化学平衡常数K= .
(2)该反应为 反应.(填“吸热”或“放热”)
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为 ℃.
(4)830℃,在1L的固定容器的密闭容器中放入2mol CO2和1mol H2,平衡后CO2的转化率为 .
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应为
(3)某温度下,平衡浓度符合下式:c(CO2)?c(H2)=c(CO)?c(H2O),试判断此时的温度为
(4)830℃,在1L的固定容器的密闭容器中放入2mol CO2和1mol H2,平衡后CO2的转化率为
考点:化学平衡的计算
专题:
分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值;
(2)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,正反应是吸热反应;
(3)根据浓度熵和平衡常数的关系来回答;
(4)令平衡时参加反应的CO2的物质的量为ymol,根据三段式用y表示出平衡时各组分的物质的量,该反应是气体体积不变的反应,用物质的量代替浓度代入平衡常数表达式列方程计算y的值,据此解答.
(2)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,正反应是吸热反应;
(3)根据浓度熵和平衡常数的关系来回答;
(4)令平衡时参加反应的CO2的物质的量为ymol,根据三段式用y表示出平衡时各组分的物质的量,该反应是气体体积不变的反应,用物质的量代替浓度代入平衡常数表达式列方程计算y的值,据此解答.
解答:
解:(1)可逆反应CO2(g)+H2(g)?CO(g)+H2O(g)的化学平衡常数表达式k=
,故答案为:
;
(2)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,正反应是吸热反应,故答案为:吸热;
(3)平衡浓度符合下式c(CO2)?c(CH2)=c(CO)?c(H2O)时,浓度熵和平衡常数相等均等于1,平衡常数只值受温度的影响,当K=1时,根据表中数据,所以温度是830℃,故答案为:830;
(4)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 1 0 0
变化(mol):y y y y
平衡(mol):2-y 1-y y y
故
=1,解得:y=
故平衡后CO2的转化率为
=
,故答案为:
.
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
| c(CO)?c(H2O) |
| c(CO2)?c(H2) |
(2)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,正反应是吸热反应,故答案为:吸热;
(3)平衡浓度符合下式c(CO2)?c(CH2)=c(CO)?c(H2O)时,浓度熵和平衡常数相等均等于1,平衡常数只值受温度的影响,当K=1时,根据表中数据,所以温度是830℃,故答案为:830;
(4)令平衡时参加反应的CO2的物质的量为ymol,则:
CO2(g)+H2(g)?CO(g)+H2O(g)
开始(mol):2 1 0 0
变化(mol):y y y y
平衡(mol):2-y 1-y y y
故
| y×y |
| (2-y)×(1-y) |
| 2 |
| 3 |
故平衡后CO2的转化率为
| ||
| 2mol |
| 1 |
| 3 |
| 1 |
| 3 |
点评:本题考查化学平衡常数、平衡常数的应用等,难度中等,注意掌握化学平衡常数的用途:1、判断反应进行的程度,2、判断反应的热效应,3、判断反应进行的方向,4、计算转化率等.

练习册系列答案
相关题目
已知H2B在溶液中的电离方程式:H2B=H++HB-,HB-?H++B2-.下列叙述一定正确的是( )
| A、Na2B溶液存在:c (Na+)=2c (HB-)+2c(B2-)+2c(H2B) |
| B、NaHB溶液一定显酸性 |
| C、HB-的水解方程式:HB-+H2O?H2B+OH- |
| D、NaHB溶液与稀盐酸反应的离子方程式是:HB-+H+=H2B |
下列六种物质:①Na20 ②Na202③CaCl2溶液④Na2C03溶液⑤NaOH ⑥NaHC03中,不能与二氧化碳反应的是( )
| A、①④ | B、②③ | C、③⑥ | D、③④⑥ |
下列关于铵盐的叙述中正确的是( )
①所有铵盐中,氮元素化合价都是-3价
②所有铵盐都溶于水
③铵态氮肥不宜与碱性物质混合使用
④铵盐中都有铵离子
⑤铵盐都能与碱反应,不能与酸反应.
①所有铵盐中,氮元素化合价都是-3价
②所有铵盐都溶于水
③铵态氮肥不宜与碱性物质混合使用
④铵盐中都有铵离子
⑤铵盐都能与碱反应,不能与酸反应.
| A、①③④ | B、②③④ |
| C、①②③④ | D、①②③④⑤ |
已研制出的臭鼬剂主要成分是丁硫醇(C4H9SH),人的口臭是由于分泌出有臭味的甲硫醇(CH3SH),液化气中添加的报警剂是极臭的乙硫醇(C2H5SH).下列说法不正确的是( )
| A、丁硫醇与甲硫醇及乙硫醇互为同系物 |
| B、沸点不同的丁硫醇有四种 |
| C、甲硫醇分子中含有四个共价键 |
| D、丁硫醇在空气中完全燃烧生成三氧化硫、二氧化碳和水 |
下列说法不正确的是( )
| A、增大压强,活化分子百分数不变,化学反应速率增大 |
| B、升高温度,活化分子百分数增大,化学反应速率增大 |
| C、加入反应物,活化分子百分数增大,化学反应速率增大 |
| D、使用催化剂,活化分子百分数增大,化学反应速率增大 |
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A、H2O(g)═H2(g)+
| ||
| B、2 H2(g)+O2(g)═2 H2O(l);△H2=-484 kJ?mol-1 | ||
C、H2(g)+
| ||
| D、2 H2(g)+O2(g)═2 H2O(g);△H2=+484 kJ?mol-1 |
 氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂.请回答:
氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂.请回答: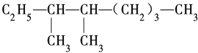 的系统命名法名称是
的系统命名法名称是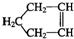 可简写为
可简写为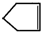 .降冰片烯的分子结构可表示为:
.降冰片烯的分子结构可表示为: