题目内容
13.某兴趣小组的同学在做用CCl4萃取碘水中碘单质(I2)的实验时,发现无论如何都无法将碘水变成完全无色的溶液,于是有同学大胆猜想萃取后的水中还含有碘单质,即萃取剂在萃取实验中有效率问题.为探究CCl4对碘水中碘单质的萃取率,该小组同学利用KI溶液自制碘水后,再用CCl4对该碘水中碘单质进行萃取,最后提纯I2的CCl4溶液中的I2用于计算萃取率.
(1)用KI固体配制250ml 1mol/L KI溶液,其正确的操作顺序是B、C、A、F、E、D.
A、用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B、用天平准确称取所需的KI的质量,加入少量水(约30mL),用玻璃棒慢慢搅拌,使其充分溶解
C、将已冷却的KI溶液沿玻璃棒注入250mL的容量瓶中
D、将容量瓶盖紧,颠倒摇匀
E、改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F、继续往容量瓶内小心加水,直到液面接近刻度线1-2cm处
(2)下列配制的溶液浓度偏高的是C.
A、配制前,容量瓶中有少量蒸馏水
B、加蒸馏水时不慎超过了刻度线
C、定容时俯视刻度线
D、向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
(3)向上述所得KI溶液通入足量Cl2充分发生反应:2KI+Cl2═I2+2KCl得到I2的水溶液,再向其中加入CCl4萃取I2.待液体分层后下层溶液为紫红色.得到下层溶液的操作是待液体分层后,将分液漏斗颈上的玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下.
(4)萃取后实验小组的同学用分液的方法得到I2的CCl4溶液,经提纯得到纯净的I231.0g,则该实验CCl4的萃取率是97.6%.
分析 (1)根据配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;
(2)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析;
(3)氯气氧化性强于碘,能够置换碘,碘易溶于四氯化碳,显紫红色;依据分液的正确操作解答;
(4)碘、四氯化碳相互溶解,二者沸点不同,选择蒸馏分离;
依据碘化钾溶液含碘化钾的物质的量计算制取的碘的质量,然后计算萃取率.
解答 解:(1)配制步骤是计算、称量、溶解、洗涤、定容、摇匀、装瓶,故正确的操作顺序:B、C、A、F、E、D,
故答案为:B、C、A、F、E、D;
(2)A、配制前,容量瓶中有少量蒸馏水,对溶质的物质的量和溶液的体积不会产生影响,溶液的浓度不变故A不选;
B、加蒸馏水时不慎超过了刻度线,导致溶液的体积偏大,溶液的浓度偏低,故不选;
C、定容时俯视刻度线,导致溶液的体积偏小,溶液的浓度偏低,故选;
D、向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面,导致溶质的物质的量偏小,溶液的浓度偏低,故不选;
故选:C;
(3)氯气的氧化性强于碘,所以向上述所得KI溶液通入足量Cl2充分发生反应:2KI+Cl2═I2+2KCl得到I2的水溶液,再向其中加入CCl4萃取I2.待液体分层后下层溶液为:紫红色;得到下层溶液的操作是:待液体分层后,将分液漏斗颈上的玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下;
故答案为:紫红;待液体分层后,将分液漏斗颈上的玻璃塞打开,或使塞上的凹槽(或小孔)对准漏斗上的小孔,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿烧杯壁流下;
(4)碘、四氯化碳相互溶解,二者沸点不同,选择蒸馏分离;250ml 1mol/L KI溶液含有碘化钾的物质的量=0.25L×1mol/L=0.25mol,依据方程式:2KI+Cl2═I2+2KCl可知生成碘0.125mol,质量为:0.125mol×254g/mol=31.75g,所以萃取率$\frac{31.0}{31.75}$×100%=97.6%,
故答案为:97.6%.
点评 本题考查了一定物质的量浓度溶液的配制,萃取实验的操作,题目难度不大,熟悉相关知识是解题关键.

| A. | 7种 | B. | 8种 | C. | 9种 | D. | 10种 |
| 成分 | 质量(g) | 摩尔质量(g.mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.32 | 158 |
| 氯化钠 | 0.08 | 58.5 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.氯化钠
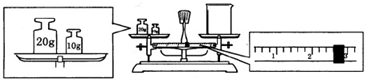
(2)某同学欲称量“鲜花保鲜剂”的质量,先用托盘天平称量烧杯的质量,天平平衡后的状态如图.则烧杯的实际质量为27.4g.
(3)配制上述一“鲜花保鲜剂”240mL所需的仪器有:烧杯、天平、药匙、量筒、玻璃棒、胶头滴管、250mL容量瓶.(在横线上填写所缺仪器的名称)
(4)容量瓶使用前必须进行的操作为检查是否漏水.
(5)“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的最浓度为0.084mol/L:若检验“鲜花保鲜剂”溶液中的SO42-,你选择的化学试剂为BaCl2(填化学式).
(6)在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是:④.
①没有洗涤烧杯和玻璃捧
②转移溶液时不慎有少量溶液洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线.




 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
 ;
; ;
;