题目内容
14.某化学实验小组欲用下列装置制备纯净的氯气及含氯化物,并探究其性质.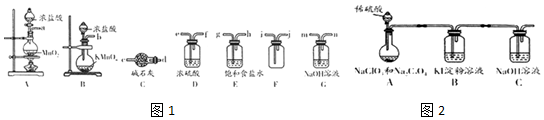
(1)欲制备并收集一瓶纯净的氯气,选择图1中合适的装置,其连接顺序为:a(或b)、g、h、e、f、i、j、d(或m)(按气流方向,用小写字母表示).根据选择的装置,写出制备氯气的化学方程式a对应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O(b对应)2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O.
(2)取100mL氯气与NaOH溶液反应生成的“84”消毒液,持续通入过量的SO2,溶液中开始出现黄绿色,后黄绿色逐渐褪去.溶液变为黄绿色的可能原因是:
①溶液中Cl-与ClO-反应所致,设计实验方案确认这种可能性:取少量“84”消毒液于试管中,滴加硫酸,观察溶液是否变为黄绿色.
②ClO-与SO2反应所致,离子方程式为2ClO-+SO2=Cl2+SO42-;向反应后的溶液中先加入足量稀盐酸,再加入足量氯化钡溶液,经过滤、洗涤、干燥、称量,所得沉淀的质量为w g,则溶液中NaC1O的物质的量浓度为$\frac{20w}{233}$mol•L-1.
(3)在加热条件下,氯气与NaOH溶液反应生成NaC1O3和NaC1等,写出反应的离子方程式3Cl2+6OH-=ClO3-+5Cl-+3H2O.实验小组设计图2装置(加热装置略去)验证NaClO3的性质.
已知:2NaClO3+Na2C2O4+2H2SO4(稀)═2C1O2↑+2CO2↑+2Na2SO4+2H2O;C1O2与氯气的化学性质相似.
控制装置A中分液漏斗活塞,缓慢滴加稀硫酸,观察到B装置中的现象是溶液变蓝;装置C吸收的物质是C1O2和CO2.
分析 (1)为制取、收集纯净干燥的氯气,并探究氯气的性质,A、B均可制备氯气,所制备的氯气中混有氯化氢气体和水蒸气,故依次选择饱和食盐水除去氯化氢,浓硫酸除去水蒸气,为除杂充分,导气管均应长进短出,F中收集干燥的氯气,氯气比空气密度大,故导气管也应长进短出,氯气污染空气,故选用碱液吸收;
(2)①依据次氯酸根离子和氯离子在酸溶液中会发生归中反应生成氯气,向漂粉精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色;
②ClO-与SO2反应所致,则生成氯气和硫酸根离子,据此书写,沉淀为硫酸钡,由硫酸钡的质量结合化学方程式计算NaC1O的浓度;
(3)氯气与NaOH溶液反应生成NaC1O3和NaC1,结合得失电子守恒和质量守恒书写;
图2中A装置发生反应:2NaClO3+Na2C2O4+2H2SO4(稀)═2C1O2↑+2CO2↑+2Na2SO4+2H2O,C1O2氧化KI为碘单质,使B装置中淀粉显蓝色,生成的C1O2和二氧化碳在C中被氢氧化钠吸收.
解答 解:(1)为制取、收集纯净干燥的氯气,并探究氯气的性质,A、B均可制备氯气,若为A,则反应为::MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,若选用B,反应为:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,所制备的氯气中混有氯化氢气体和水蒸气,故依次选择饱和食盐水除去氯化氢,浓硫酸除去水蒸气,为除杂充分,导气管均应长进短出,F中收集干燥的氯气,氯气比空气密度大,故导气管也应长进短出,氯气污染空气,故选用碱液吸收,则连接顺序为:a(或b)、g、h、e、f、i、j、d(或m);
故答案为:a(或b)、g、h、e、f、i、j、d(或m);a对应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O(b对应)2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O;
(2)①随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.通过进一步实验确认这种可能性,漂粉精中成分为次氯酸钙、氯化钙,次氯酸根具有强氧化性在酸性溶液中可以氧化氯离子为氯气,方法为:取少量“84”消毒液于试管中,滴加硫酸,观察溶液是否变为黄绿色;
故答案为:取少量“84”消毒液于试管中,滴加硫酸,观察溶液是否变为黄绿色;
②ClO-与SO2生成氯气和硫酸根离子,离子方程式为:2ClO-+SO2=Cl2+SO42-;向反应后的溶液中先加入足量稀盐酸,再加入足量氯化钡溶液,经过滤、洗涤、干燥、称量,所得沉淀的质量为w g,该沉淀为硫酸钡沉淀,n(BaSO4)=$\frac{w}{233}$mol,根据2ClO-~SO42-~BaSO4,则溶液中NaC1O的物质的量浓度为
$\frac{2×\frac{w}{233}mol}{0.1L}$=$\frac{20w}{233}$mol/L;
故答案为:2ClO-+SO2=Cl2+SO42-;$\frac{20w}{233}$;
(3)氯气与NaOH溶液反应生成NaC1O3和NaC1,结合得失电子守恒和质量守恒可得3Cl2+6OH-=ClO3-+5Cl-+3H2O;
图2中A装置发生反应:2NaClO3+Na2C2O4+2H2SO4(稀)═2C1O2↑+2CO2↑+2Na2SO4+2H2O,C1O2氧化KI为碘单质,使B装置中淀粉显蓝色,生成的C1O2和二氧化碳在C中被氢氧化钠吸收;
故答案为:3Cl2+6OH-=ClO3-+5Cl-+3H2O;溶液变蓝;C1O2和CO2.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,难度中等.

| A. | 食盐可作调味剂,也可作食品防腐剂 | |
| B. | Na2O2和Na2O均可常用作呼吸面具中的供氧剂 | |
| C. | “熬胆矾铁釜,久之亦化为铜”,是因为熬制过程发生了置换反应 | |
| D. | 古剑“沈卢”“以剂钢为刃”柔铁为蒸干,不尔则多断折”,剂钢是指铁合金 |
| A. | 控制工业废水的排放 | B. | 对河水进行消毒处理 | ||
| C. | 控制农田排水 | D. | 减少用水量 |
| A. | 加水稀释时.在$\frac{c(O{H}^{-})}{C({H}^{+})}$的值增大的溶液中可大量存在:MnO4-、CO32-、K+、NH4+ | |
| B. | 100℃时,将pH=2的硫酸溶液与pH=12的氢氧化钠溶液等体积混合,溶液显中性 | |
| C. | 25℃时,NaB溶液的pH=9,则c(Na+ )-c(B-)=9.9×10-6mol•L-1 | |
| D. | 将0.2mol•L-1 的一元弱酸HA溶液和0.1mol•L-1 的NaOH溶液等体积混合:2c(OH-)+c(A-)=2c(H+)+c(HA) |

| A. | 电子由Al电极通过外电路流向Ag2O/Ag电极 | |
| B. | 电池负极附近溶液pH升高 | |
| C. | 正极反应式为:Ag2O+2e-+H2O=2Ag+2OH- | |
| D. | 负极会发生副反应:2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
| A. | NaHCO3水解的离子方程式:HCO3-+H2O?CO32-+H2O- | |
| B. | Ca(OH)2的电离方程式:Ca(OH)2?Ca2++2OH- | |
| C. | AgCl 的沉淀溶解平衡表达式:AgCl(s)?Ag+(aq)+CI“(aq) | |
| D. | Na2S 水解的离子方程式:S2-+2H2O?H2S+2OH- |
| A. | 加热胆矾失去结晶水,得到白色无水硫酸铜,这一过程叫风化 | |
| B. | 家用石碱(主要成分是Na2CO3•10H2O )久置后,由块状变成粉末状,这一变化是风化的结果 | |
| C. | 含有水蒸气的气体通过固体NaOH 时,固体表面出现水珠,这是固体氢氧化钠潮解的原故 | |
| D. | 从冰箱取出物品,表面很快出现水珠,这种现象叫潮解 |