题目内容
8.下列有关关系式错误的是( )| A. | 含1mo1K0H的溶液与1mo1CO2完全反应后,溶液中c(K+)>c(HCO3- ) | |
| B. | 0.2mo1/LCH3COOH溶液与0.1mo1/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| C. | 将100mL0.1mo1.L-1的醋酸稀释至pH=4:n(CH3COO-)+n(CH3COOH)=0.01mo1 | |
| D. | pH=5的NaHSO3溶液中:c(HSO3-)+c(SO32-)=c(Na+) |
分析 A.二者恰好反应生成KHCO3,钾离子不水解、碳酸氢根离子水解;
B.二者混合后溶液中溶质为等物质的量浓度的CH3COONa、CH3COOH,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.pH=5的亚硫酸氢钠溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒判断.
解答 解:A.二者恰好反应生成KHCO3,钾离子不水解、碳酸氢根离子水解,所以存在c(K+)>c(HCO3- ),故A正确;
B.二者混合后溶液中溶质为等物质的量浓度的CH3COONa、CH3COOH,溶液中存在电荷守恒和物料守恒,
根据物料守恒有:c(CH3COO-)+c(CH3COOH)=2c(Na+),
根据电荷守恒有:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),
整理得:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故B正确;
C.任何电解质溶液中都存在物料守恒,根据物料守恒n(CH3COO-)+n(CH3COOH)=0.1mol/L×0.1L=0.01mo1,故C正确;
D.pH=5的亚硫酸氢钠溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒得c(HSO3-)+2c(SO32-)=c(Na+),故D错误;
故选D.
点评 本题考查离子浓度大小比较,为高频考点,把握物料守恒、电荷守恒是解本题关键,注意守恒思想的灵活运用,题目难度不大.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案
相关题目
18.下列化学用语表示正确的是( )
| A. | 聚丙烯的结构简式: | B. | NH4Br的电子式: | ||
| C. | 对羟基苯甲醛的结构简式: | D. | 二氧化碳分子的比例模型: |
12.25℃时,将25.00mLHgI2饱和溶液分数次加入离子交换柱中,进行如下离子交换反应:Hg2+(aq)+2RH(s)=R2Hg(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据,下列有关说法正确的是( )
| A. | 其他步骤正确,滴定达到终点时,俯视读数,测得c(H+)偏大 | |
| B. | 实验测得25℃时,HgI2的Ksp=4×10-9 | |
| C. | 一定温度下,向HgI2饱和溶液中加入少量Hg(NO3)2溶液,HgI2的Ksp减小 | |
| D. | 温度不变,在t时,向HgI2饱和溶液中加入少量浓KI溶液,离子浓度变化如图所示 |
9.Ⅰ.现有浓度均为0.1mol•L -1的下列溶液:
①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨
水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)④②③①.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)⑥⑦④⑤⑧.
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是A.
A.c(Na+)=c(C1-)>c(OH-)>c(NH4+)
B.c(Na+)=0.1mol•L-1
C.c(Na+)+c(NH4+)=c(C1-)+c(OH-)
D.c(H+)>c(OH-)
Ⅱ.如表是不同温度下水的离子积的数据:
试回答以下问题:
(1)若25<t l<t 2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是水的电离为吸热反应,升高温度,平衡向着正反应方向移动.
(2)25℃时,某Na2S04溶液中c(S042-)=5×10-4 mol•L-1,取该溶液l mL加水稀释至10mL,则
稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)在t2温度下,将pH=11的NaOH溶液a L与pH=1的H2S04溶液b L混合,若所得混合液pH=2,则a:b=9:11.
①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤醋酸铵 ⑥硫酸铵 ⑦硫酸氢铵 ⑧氨
水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)④②③①.
(2)④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)⑥⑦④⑤⑧.
(3)将③和④等体积混合后,混合液中各离子浓度关系正确的是A.
A.c(Na+)=c(C1-)>c(OH-)>c(NH4+)
B.c(Na+)=0.1mol•L-1
C.c(Na+)+c(NH4+)=c(C1-)+c(OH-)
D.c(H+)>c(OH-)
Ⅱ.如表是不同温度下水的离子积的数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t l<t 2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是水的电离为吸热反应,升高温度,平衡向着正反应方向移动.
(2)25℃时,某Na2S04溶液中c(S042-)=5×10-4 mol•L-1,取该溶液l mL加水稀释至10mL,则
稀释后溶液中c(Na+):c(OH-)=1000:1.
(3)在t2温度下,将pH=11的NaOH溶液a L与pH=1的H2S04溶液b L混合,若所得混合液pH=2,则a:b=9:11.
 ,其与过量的NaOH溶液反应的化学方程式是
,其与过量的NaOH溶液反应的化学方程式是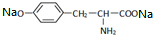 +2H2O.
+2H2O.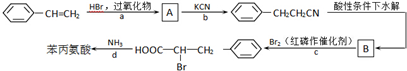
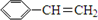 +HBr→
+HBr→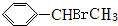 .
. +Br2$\stackrel{红磷}{→}$
+Br2$\stackrel{红磷}{→}$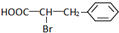 +HBr.
+HBr.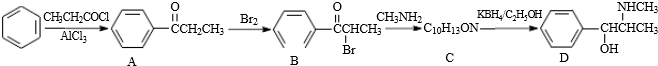
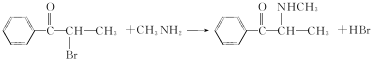 .C-D的反应类型为还原反应.
.C-D的反应类型为还原反应.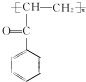
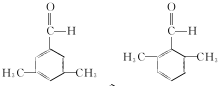 (写结构简式).
(写结构简式). 参照上述合成路线,设计一条由苯和乙酸为起始原料制备
参照上述合成路线,设计一条由苯和乙酸为起始原料制备 的合成路线:
的合成路线: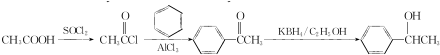 .
.