题目内容
已知:
①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
②2H2(g)+SO2(g)?S(g)+2H2O(g)△H=90.4kJ/mol
③2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ/mol
请回答:
(1)上述变化过程中放出热量的是 (填序号,下同),吸收热量的是 .
(2)4g H2 (g) 完全反应生成甲醇气体时,△H= kJ/mol.
(3)生成1mol NH3 (g) 的反应热为 kJ/mol.
①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
②2H2(g)+SO2(g)?S(g)+2H2O(g)△H=90.4kJ/mol
③2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ/mol
请回答:
(1)上述变化过程中放出热量的是
(2)4g H2 (g) 完全反应生成甲醇气体时,△H=
(3)生成1mol NH3 (g) 的反应热为
考点:热化学方程式
专题:化学反应中的能量变化
分析:(1)依据反应的焓变分析,焓变小于0 反应放热,焓变大于0反应是吸热反应;
(2)依据热化学方程式③计算得到;
(3)依据热化学方程式①的定量关系计算.
(2)依据热化学方程式③计算得到;
(3)依据热化学方程式①的定量关系计算.
解答:
解:(1)①N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,焓变小于0,反应是放热反应;
②2H2(g)+SO2(g)?S(g)+2H2O(g)△H=90.4kJ/mol,焓变大于0,反应是吸热反应;
③2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ/mol,焓变小于0,反应是放热反应,
故答案为:①③;②;
(2)2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ/mol,
4g H2(g) 完全反应生成甲醇气体时放热90.8kJ;
故答案为:-90.8;
(3)N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
生成1mol NH3 (g) 的反应热为-46.2KJ/mol;
故答案为:-46.2;
②2H2(g)+SO2(g)?S(g)+2H2O(g)△H=90.4kJ/mol,焓变大于0,反应是吸热反应;
③2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ/mol,焓变小于0,反应是放热反应,
故答案为:①③;②;
(2)2H2(g)+CO(g)?CH3OH(g)△H=-90.8kJ/mol,
4g H2(g) 完全反应生成甲醇气体时放热90.8kJ;
故答案为:-90.8;
(3)N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
生成1mol NH3 (g) 的反应热为-46.2KJ/mol;
故答案为:-46.2;
点评:本题考查了热化学方程式的书写方法和计算应用,注意焓变判断反应能量的变化,题目较简单.

练习册系列答案
相关题目
利用石棉隔膜电解槽电解饱和食盐水时,以下工艺不正确的是( )
| A、用石墨作阳极 |
| B、用铁丝网作阴极 |
| C、饱和食盐水从阴极室向电解槽中注入 |
| D、电解前,对粗食盐水进行精制 |
下列反应的离子方程式中写不正确的是( )
| A、石灰石溶于盐酸:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、氯水滴加到氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
| C、铁和硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu |
| D、稀硫酸和氢氧化钠溶液混合:H++OH-═H2O |
20℃时,有体积相同的四种溶液:①pH=3的CH3COOH溶液 ②pH=3的盐酸 ③pH=11的氨水 ④pH=11的NaOH溶液.下列说法不正确的是( )
| A、若将四种溶液稀释100倍,溶液pH的大小顺序:③>④>①>② |
| B、③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④ |
| C、①与②混合,所得混合溶液的pH=3 |
| D、②和③混合后,溶液呈碱性 |
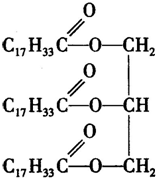 试从某油脂结构简式,分析它可能发生的化学反应:
试从某油脂结构简式,分析它可能发生的化学反应: