题目内容
下表列出了①~⑥六种元素在元素周期表中的位置.
请回答下列问题:
(1)①、②、③三种元素相比较,非金属性最强的是 (填写元素符号);
(2)元素⑥的氢化物的分子式是 ;
(3)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是
.
| 族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ |
(1)①、②、③三种元素相比较,非金属性最强的是
(2)元素⑥的氢化物的分子式是
(3)④、⑤两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知,①为C、②为O、③为F、④为Na、⑤为Al、⑥为S,
(1)同周期自左而右元素非金属性增强;
(2)⑥为S元素,最低负化合价为-2,据此书写氢化物化学式;
(3)④、⑤两种元素的最高价氧化物对应的水化物分别为氢氧化铝、NaOH,二者反应生成偏铝酸钠与水.
(1)同周期自左而右元素非金属性增强;
(2)⑥为S元素,最低负化合价为-2,据此书写氢化物化学式;
(3)④、⑤两种元素的最高价氧化物对应的水化物分别为氢氧化铝、NaOH,二者反应生成偏铝酸钠与水.
解答:
解:由元素在周期表中的位置可知,①为C、②为O、③为F、④为Na、⑤为Al、⑥为S,
(1)①、②、③同周期,原子序数依次增大,自左而右元素非金属性增强,故F元素非金属性最强,故答案为:F;
(2)⑥为S元素,最低负化合价为-2,其氢化物化学式为H2S,故答案为:H2S;
(3)④、⑤两种元素的最高价氧化物对应的水化物分别为氢氧化铝、NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
(1)①、②、③同周期,原子序数依次增大,自左而右元素非金属性增强,故F元素非金属性最强,故答案为:F;
(2)⑥为S元素,最低负化合价为-2,其氢化物化学式为H2S,故答案为:H2S;
(3)④、⑤两种元素的最高价氧化物对应的水化物分别为氢氧化铝、NaOH,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O.
点评:本题考查元素周期表与元素周期律等,难度不大,注意整体把握元素周期表,理解元素周期律.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
目前,全世界提倡“低碳生活”的理念,号召大家减少使用能产生CO2的燃料.下列燃料燃烧时不会产生CO2的是( )
| A、煤 | B、天然气 | C、石油 | D、氢气 |
为实现“绿色奥运”,下列建议不合理的是( )
| A、推广使用无磷洗涤剂 |
| B、推广垃圾分类存放、回收和处理 |
| C、提倡使用手帕,减少餐巾纸的使用 |
| D、提倡使用一次性塑料餐具和塑料袋 |
 某原电池结构如右图所示,下列有关该原电池的说法正确的是( )
某原电池结构如右图所示,下列有关该原电池的说法正确的是( )| A、铜棒为负极 |
| B、镁棒发生还原反应 |
| C、电子从铜棒经外电路流向镁棒 |
| D、电池反应为Mg+2H+=Mg2++H2↑ |


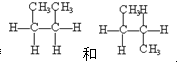


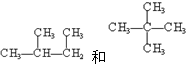




 ③CH3CHO、④CH3COOH中,俗称醋酸的是
③CH3CHO、④CH3COOH中,俗称醋酸的是