题目内容
4.把质量为 m g的Cu丝灼烧变黑,立即放入下列物质中,使Cu丝变红,而且质量仍为 m g的是( )| A. | 稀H2SO4 | B. | C2H5OH | C. | 稀HNO3 | D. | CH 3COOH(aq) |
分析 先铜丝灼烧成黑色,生成CuO:2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,插入溶液中能使铜丝变红,而且质量仍为mg,说明CuO被还原生成Cu,以此解答该题.
解答 解:A.铜丝灼烧成黑色,立即放入稀硫酸中CuO被溶解,生成Cu 2+进入溶液,质量减少,故A错误;
B.铜丝灼烧成黑色,立即放入C2H5OH中,CuO与C2H5OH反应:CuO+C2H5OH$\stackrel{△}{→}$CH3CHO+Cu+H2O,反应后铜丝质量保持不变,故B正确;
C.铜丝灼烧成黑色,立即放入稀硝酸中,CuO、Cu与稀硝酸反应,生成铜盐,质量减少,故C错误;
D.铜丝灼烧成黑色,立即放入CH3COOH中,CuO与CH3COOH反应,生成铜盐,铜丝质量减少,故D错误.
故选B.
点评 本题综合考查了铜及其化合物的性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,难度不大,注意乙醇与氧化铜反应的性质.

练习册系列答案
相关题目
15.下列物质不能由单质直接化合得到的是( )
| A. | NO | B. | Cu2S | C. | FeCl3 | D. | FeCl2 |
12.下列热化学方程式书写正确的是( )
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ/mol | |
| B. | 2SO2+O2?2SO3;△H=-196.6 kJ/mol | |
| C. | 2H2(g)+O2(g)═2H2O(l);△H=-571.6 kJ | |
| D. | C(s)+O2(g)═CO2(g);△H=+393.5 kJ/mol |
19.一定温度下,在固定容积的密闭容器中发生下列反应:2HI(g)?H2(g)+I2(g).若HI的浓度由0.1mol•L-1降到0.07mol•L-1时需要15s,则HI的浓度由0.07mol•L-1降到0.05mol•L-1时,所需时间为( )
| A. | 等于15 s | B. | 等于10 s | C. | 大于10s | D. | 小于10 s |
13.从2011年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从浙江沿海地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素.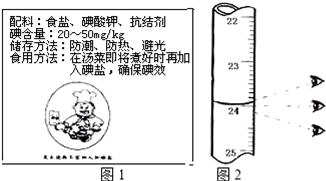
Ⅰ.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为50mg/kg,要达到上述碘含量要求,需服用该碘盐2kg,你觉得服用碘盐防辐射合理吗?不合理
Ⅱ.如图1为某加碘盐标签的一部分.
已知:
①KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
②I2+2Na2S2O3═2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄
色,再加入3滴淀粉溶液.
步骤2:取一支50.00mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
(1)第一次读数为24.00mL.
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算此加碘盐碘元素的含量为$\frac{508000b}{a}$mg/kg(用包含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏高的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失.

Ⅰ.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为50mg/kg,要达到上述碘含量要求,需服用该碘盐2kg,你觉得服用碘盐防辐射合理吗?不合理
Ⅱ.如图1为某加碘盐标签的一部分.
已知:
①KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
②I2+2Na2S2O3═2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄
色,再加入3滴淀粉溶液.
步骤2:取一支50.00mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算此加碘盐碘元素的含量为$\frac{508000b}{a}$mg/kg(用包含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏高的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失.
10.下列各组顺序的排列不正确的是( )
| A. | 热稳定性:HCl>H2S>PH3 | B. | 酸性强弱:H4SiO4<H2CO3<HNO3 | ||
| C. | 金属性:Na<Mg<Al | D. | 熔点:金刚石>食盐>干冰 |
 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置: