题目内容
11.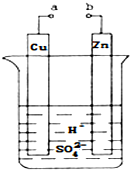 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:(1)a和b用导线连接,Cu极为原电池正极(填“正”或“负”),电极反应式为Zn极发生氧化(填“氧化”或“还原”)反应.溶液中H+移向Cu(填“Cu”或“Zn”)极.
(2)无论a和b是否连接,Zn片均被腐蚀.若转移了0.2mol电子,则理论上Zn片质量减轻6.5g.
(3)有同学想把Ba(OH)2•8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为可行?否(填“是”或“否”),理由是此反应为非氧化还原反应,且反应吸热.
分析 (1)a和b用导线连接,该装置构成原电池,锌失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,电解质溶液中阳离子向正极移动;
(2)根据锌与转移电子之间的关系式计算;
(3)原电池反应必须是自发进行的放热的氧化还原反应.
解答 解:(1)a和b用导线连接,该装置构成原电池,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑;锌失电子发生氧化反应而作负极,放电时,电解质溶液中氢离子向正极铜电极移动,
故答案为:正;氧化;Cu;
(2)负极电极反应为:Zn-2e-=Zn2+,锌片减少的质量=$\frac{0.2mol}{2}$×65g/mol=6.5g,
故答案为:6.5;
(3)原电池反应必须是自发进行的放热的氧化还原反应,该反应是吸热反应且不是氧化还原反应,所以不能设计成原电池,故答案为:否;此反应为非氧化还原反应,且反应吸热.
点评 本题考查了原电池原理及原电池设计,根据原电池反应特点、电极反应等知识点分析解答,铜锌原电池中电池反应式与锌发生化学腐蚀离子反应相同,题目难度不大.

练习册系列答案
相关题目
4.把质量为 m g的Cu丝灼烧变黑,立即放入下列物质中,使Cu丝变红,而且质量仍为 m g的是( )
| A. | 稀H2SO4 | B. | C2H5OH | C. | 稀HNO3 | D. | CH 3COOH(aq) |
2.等浓度的下列溶液:①碳酸钠,②碳酸氢钠,③苯酚钠.溶液pH由小到大排列的是( )
| A. | ①②③ | B. | ②①③ | C. | ③①② | D. | ②③① |
6.通常用来衡量一个国家石油化工发展水平标志的是( )
| A. | 甲烷的产量 | B. | 乙醇的产量 | C. | 乙烯的产量 | D. | 乙酸的产量 |
 (1)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为Cu,当线路中转移0.1mol电子时,则被腐蚀铜的质量为3.2g,正极的电极方程式为2Fe3++2e-=2Fe2+.
(1)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu═2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为Cu,当线路中转移0.1mol电子时,则被腐蚀铜的质量为3.2g,正极的电极方程式为2Fe3++2e-=2Fe2+.