题目内容
17.1100℃时,在恒容密闭容器中,发生可逆反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g)并达到平衡,请完成下列各题:(1)上述反应中涉及的元素原子的半径从大到小的顺序为Na>S>O>H,非金属性最强的元素原子的轨道表示式
 ,其电子的自旋方向共有2种.比较两种同主族非金属元素形成的单质的氧化性(用化学方程式表示)2H2S+O2=2S↓+2H2O
,其电子的自旋方向共有2种.比较两种同主族非金属元素形成的单质的氧化性(用化学方程式表示)2H2S+O2=2S↓+2H2O(2)上述平衡的平衡常数表达式K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$.降低温度,K值减小,则正反应为吸热(填“吸热”或“放热”)反应.
(3)能判断反应达到平衡状态的依据是(填序号)BC.
A.混合气体的压强不变
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.各气体的浓度相等
(4)平衡后,向容器中充入1molH2,重新达到平衡,与原平衡相比,H2的转化率不变;体积百分含量bb(填“增大”、“减小”或“不变”)
(5)若初始时加入的Na2SO4为2.84g,达平衡时Na2SO4的转化率为45%,则达平衡时该容器内固体的总质量是2.264g.
分析 (1)所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大;
非金属性最强的元素为O元素,原子核外电子排布式为1s22s22p4,根据泡利原理与洪特规则画出原子的轨道表示式,电子的自旋方向共有2种;
同主族非金属元素形成的单质为氧气、硫,可以利用单质之间置换反应比较单质的氧化性强弱;
(2)平衡常数是指生成物平衡浓度化学计量数幂乘积与反应物平衡浓度化学计量数幂乘积的比,固体不需要标出;
降低温度,K值减小,说明降低温度平衡向逆反应方向移动;
(3)A.混合气体的压强始终不变;
B.混合气体的总质量随反应进行发生变化,容器容积不变,混合气体的密度不变可以说明到达平衡;
C.混合气体的总物质的量不变,总质量分数变化,故混合气体的平均相对分子质量不变,可以说明到达平衡;
D.平衡时气体的浓度与反应物转化率有关;
(4)平衡后,向容器中充入1molH2,等效为再原平衡的基础上增大压强,平衡不移动;
(5)固体减少质量为参加反应的Na2SO4中氧元素质量.
解答 解:(1)所有元素中H原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径:Na>S>O>H;
非金属性最强的元素为O元素,原子核外电子排布式为1s22s22p4,原子的轨道表示式为 ,电子的自旋方向共有2种;
,电子的自旋方向共有2种;
同主族非金属元素形成的单质为氧气、硫,利用单质之间置换反应比较单质的氧化性强弱,反应方程式为:2H2S+O2=2S↓+2H2O,
故答案为:Na>S>O>H; ;2;2H2S+O2=2S↓+2H2O;
;2;2H2S+O2=2S↓+2H2O;
(2)Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g)的平衡常数表达式K=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$;
降低温度,K值减小,说明降低温度平衡向逆反应方向移动,逆反应为放热反应,则正反应为吸热反应,
故答案为:$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$;吸热;
(3)A.反应前后气体的物质的量不变,混合气体的压强始终不变,故A错误;
B.混合气体的总质量随反应进行发生变化,容器容积不变,混合气体的密度不变可以说明到达平衡,故B正确;
C.混合气体的总物质的量不变,总质量分数变化,故混合气体的平均相对分子质量不变,可以说明到达平衡,故C正确;
D.平衡时气体的浓度与反应物转化率有关,平衡时的浓度不一定相等,故D错误,
故选:BC;
(4)平衡后,向容器中充入1molH2,等效为再原平衡的基础上增大压强,平衡不移动,与原平衡相比,H2的转化率不变,体积百分含量不变,
故答案为:不变;不变;
(5)若初始时加入的Na2SO4为2.84g,达平衡时Na2SO4的转化率为45%,则反应的硫酸钠为$\frac{2.84g×45%}{142g/mol}$=
0.009mol,固体减少质量为参加反应的Na2SO4中氧元素质量,则达平衡时该容器内固体的总质量是 2.84g-0.009mol×4×16g/mol=2.264g,
故答案为:2.264g.
点评 本题考查元素周期律、平衡常数、化学平衡状态判断、化学平衡计算与影响因素等知识点,侧重考查学生分析解决问题的能力,难度中等.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案| A. | 对有气体参加的化学反应,通过减小体积增大体系压强,可使单位体积内活化分子数增加,因而反应速率增大 | |
| B. | 升高温度,主要是因为分子运动加剧,碰撞频率提高,因而反应速率增大 | |
| C. | 活化分子之间发生的碰撞一定为有效碰撞 | |
| D. | 加入适宜的催化剂,可使活化能增大,从而加快反应速率 |
 某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
某校实验室合成环己烯的反应和实验装置(夹持及加热部分已省略)如下:
相关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
Ⅰ.[合成]:在a中加入20.00g纯环己醇及2小块沸石,冷却搅动下缓慢加入10mL浓硫酸.b中通入冷却水后,缓慢加热a,控制馏出物的温度不超过90℃.
Ⅱ.[提纯]:将反应后粗产物倒入分液漏斗中,依次用少量5% Na2CO3溶液和水洗涤,分离后加入无水CaCl2颗粒,静置一段时间后弃去CaCl2.再进行蒸馏最终获得12.30g纯环己烯.
回答下列问题:
(1)装置b的名称是直形冷凝管.加入沸石的目的是防止混合液爆沸.
(2)本实验分液所得产物应从上口倒出(填“上口”或“下口”).
(3)提纯过程中加入Na2CO3溶液的目的是除去多余的H2SO4,加入无水CaCl2的作用是干燥所得环己烯(产物).
(4)本实验所得环己烯的产率是75%(产率=$\frac{实际产量}{理论产量}$×100%)
 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用.工业上一般采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H1
下表所列数据是以上反应在不同温度下的化学平衡常数的数值:
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
Ⅱ、某温度下,将1mol CO和4mol H2充入2L的密闭容器中,充分反应达到平衡后,测得c(CO)=0.1mol/L,则CO的转化率为80%,此时的温度>250℃(填“>”、“<”、“=”)
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H1=-Q1kJ/mol
②2CO (g)+O2(g)=2CO2(g)△H2=-Q2 kJ/mol
③H2O(g)=H2O(l)△H3=-Q3 kJ/mol
请写出甲醇发生不完全燃烧生成一氧化碳和气态水的热化学反应方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H=-(0.5Q1-0.5Q2-2Q3)kJ/mol
(3)某同学依据甲醇燃烧的反应原理,设计如右图所示的电池装置,工作一段时间后,测得溶液的pH将降低(填“升高”、“降低”、“不变”),该燃料电池负极反应的离子方程式为:CH3OH-6e-+8OH-═CO32-+6H2O.
| A. | 物质的量不是1mol | B. | 含的氧原子个数为1mol | ||
| C. | 质子数是2mol | D. | 氧分子个数为1mol |



 ),试写出该两步反应对应的化学方程
),试写出该两步反应对应的化学方程 ;
;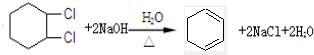 .
.