题目内容
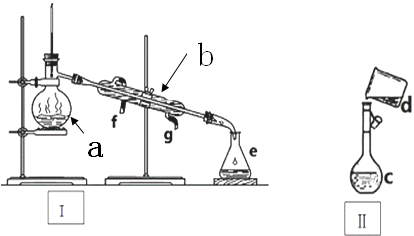
12.硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用.现利用反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2来制备Na2S2O3,所需仪器如图所示.
(1)按气流方向连接各仪器,接口顺序为:a→g,h→b,c→e,f→d.
(2)A仪器名称为分液漏斗.
(3)装置甲的作用是用作安全瓶,防止丙中液体倒吸,装置丁的作用是除去多余的二氧化硫,防止二氧化硫进入空气中污染大气.
(4)装置丙中盛装的试剂是:Na2CO3和Na2S的混合溶液.
(5)Na2S2O3还原性较强,工业上常用作除去溶液中残留的Cl2,在该反应中Na2S2O3只作还原剂,则离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+.
(6)请设计简单的实验方案,证明上述残留的Cl2被还原成了Cl-(试剂自选):取少量反应后的溶液于试管中,滴入Ba(NO3)2溶液至不再产生沉淀,再取上层清液(或过滤后取滤液),滴加AgNO3溶液,若产生白色沉淀,则说明Cl2被还原为了Cl-.
分析 (1)装置gh是浓硫酸和亚硫酸钠反应生成二氧化硫气体的装置,装置bc是安全瓶,导气管略露出胶塞,起到防止倒吸的作用,二氧化硫是污染性气体实验结束后不能排放到大气中,装置d中的反应结束后,先关闭分液漏斗旋塞,接下来的操作是关闭K1打开K2;
(2)A仪器名称为分液漏斗,可用于将互不相溶的液体与液体分开,也可以进行萃取,在反应装置中能通过滴加液体的速率控制反应;
(3)装置甲是安全瓶,导气管略露出胶塞,起到防止倒吸的作用,二氧化硫是污染性气体实验结束后不能排放到大气中,装置丁的作用是除去多余的二氧化硫;
(4)装置丙中发生反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,装置丙中盛放Na2CO3和Na2S混合物;
(5)Na2S2O3与足量氯水反应,氯气是强氧化剂,硫代硫酸钠中硫元素被氧化为硫酸根,氯气中氯元素被还原为C1-;
(6)证明残留的Cl2被还原成了Cl-,先加入硝酸钡除掉硫酸根,然后检验氯离子.
解答 解:(1)装置gh是浓硫酸和亚硫酸钠反应生成二氧化硫气体的装置,装置bc是安全瓶,导气管略露出胶塞,起到防止倒吸的作用,二氧化硫是污染性气体实验结束后不能排放到大气中,装置d中的反应结束后,先关闭分液漏斗旋塞,接下来的操作是关闭K1打开K2,接口顺序为:a→g,h→b,c→e,f→d,
故答案为:a;b;c;e;f;
(2)根据仪器的构造,A仪器带有活塞为分液漏斗,在该实验中能控制滴加浓硫酸的速率,
故答案为:分液漏斗;
(3)浓硫酸和亚硫酸钠反应生成二氧化硫气体,装置丙中发生反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,为防止丙装置中的液体倒吸到装置gh中,装置bc导气管略露出胶塞,起到防止倒吸的作用,是安全瓶,二氧化硫是污染性气体,防止二氧化硫进入空气中污染大气,装置丁的作用是除去多余的二氧化硫,
故答案为:用作安全瓶,防止丙中液体倒吸;除去多余的二氧化硫,防止二氧化硫进入空气中污染大气;
(4)装置丙中发生反应2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,盛装的试剂是Na2CO3和Na2S的混合溶液,
故答案为:Na2CO3和Na2S的混合溶液;
(5)根据氧化还原反应的实质得失电子守恒,S2O32-→2SO42-~8e-,Cl2→2CI-~2e-,所以4molCl2氧化1molS2O32-,得到8molCl-和2molSO42-,根据电荷守恒,生成物中应有10molH+,根据原子守恒反应物中应有5molH2O,离子方程式为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+,
故答案为:S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+;
(6)加入硝酸钡除掉硫酸根,然后检验氯离子.取少量反应后的溶液于试管中,滴入Ba(NO3)2溶液至不再产生沉淀,再取上层清液(或过滤后取滤液),滴加AgNO3溶液,若产生白色沉淀,则说明Cl2被还原为了Cl-,
故答案为:取少量反应后的溶液于试管中,滴入Ba(NO3)2溶液至不再产生沉淀,再取上层清液(或过滤后取滤液),滴加AgNO3溶液,若产生白色沉淀,则说明Cl2被还原为了Cl-.
点评 本题考查硫代硫酸钠的制备,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,提高学生的学科素养.

| A. | Mg2+、Ba2+、Cu2+、Cl- | B. | Fe3+、Fe2+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | ||
| C. | H+、Mg2+、MnO${\;}_{4}^{-}$、NO${\;}_{3}^{-}$ | D. | Na+、K+、NO${\;}_{3}^{-}$、Cl- |
(1)常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-55.7kJ/mol
②2CH3OH(l)?CH3OCH3(g)+H2O (l)△H=-23.4kJ/mol
则CO2(g)加氢转化为CH3OCH3(g)和H2O (l)的热化学方程式是:2CO2(g)+6H2(g)=CH3OCH3(g)+3 H2O(l)△H=-134.8kJ/mol.
(2)CO2合成尿素的反应为:CO2(g)+2NH3(g)?CO(NH2)2(l)+H2O (g)△H<0.该反应的平衡常数表达式为$\frac{c({H}_{2}O)}{c(C{O}_{2})×{c}^{2}(N{H}_{3})}$.
(3)实验室模拟用CO和H2反应来制甲醇:CO(g)+2H2(g)?CH3OH(g)△H<0.在250℃下,将一定量的CO和H2投入10L的密闭容器中,各物质的物质的量浓度(mol•L-1)变化如下表所示:(前6min没有改变条件)
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②250℃时该反应的平衡常数K值为:$\frac{0.04}{0.06×0.1{2}^{2}}$mol-2.L2(不必化简).
③若6min~8min只改变了某一条件,所改变的条件是加入1mol氢气.
④第8min时,该反应是不是达到平衡状态不是.(填“是”或“不是”)
⑤该合成反应的温度一般控制在240~270℃,选择此温度的原因是:Ⅰ.此温度下的催化剂活性高;Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
| 甲 | 乙 | 丙 | 丁 | ||
| 起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
| n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
| 含硫反应物的平衡转化率% | 80 | a1 | a2 | a3 | |
| A. | 该温度下,平衡常数的值为400 | B. | 平衡时,丙中c(SO3)是甲中的2倍 | ||
| C. | 平衡时,a3>a1 | D. | 乙中SO3的平衡转化率为a1=20% |
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾. ,其电子的自旋方向共有2种.比较两种同主族非金属元素形成的单质的氧化性(用化学方程式表示)2H2S+O2=2S↓+2H2O
,其电子的自旋方向共有2种.比较两种同主族非金属元素形成的单质的氧化性(用化学方程式表示)2H2S+O2=2S↓+2H2O