题目内容
在一定温度下,10L密闭容器中加入5mol SO2、4.5mol O2,经10min后反应达平衡时有3mol SO2发生了反应.试计算:
(1)O2的转化率为多少?
(2)用SO2表示该反应的反应速率为多少?
(3)平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
(4)平衡时体系中SO3的百分含量(体积分数)为多少?
(5)平衡常数K为多少?
(1)O2的转化率为多少?
(2)用SO2表示该反应的反应速率为多少?
(3)平衡时容器内气体压强与反应前的压强之比为多少?(最简整数比)
(4)平衡时体系中SO3的百分含量(体积分数)为多少?
(5)平衡常数K为多少?
考点:化学平衡的计算
专题:化学平衡专题
分析:10L密闭容器中加入5.0molSO2、4.5molO2,c(SO2)=0.50mol/L,c(O2)=0.45mol/L,经10min后反应达平衡时反应的SO2的浓度为0.30mol/L,
则 2SO2+O2 ?2SO3
起始浓度(mol/L) 0.50 0.45 0
变化浓度(mol/L) 0.30 0.15 0.30
平衡浓度(mol/L) 0.20 0.30 0.30
(1)利用反应的浓度和起始浓度计算转化率;
(2)依据反应速率v=
计算得到;
(3)同温同压下,物质的量与压强成正比,则利用反应前后的物质的量之和计算压强的比值;
(4)平衡时气体体积分数和物质的量分数相同;
(5)K为生成物浓度幂之积与反应物浓度幂之积的比.
则 2SO2+O2 ?2SO3
起始浓度(mol/L) 0.50 0.45 0
变化浓度(mol/L) 0.30 0.15 0.30
平衡浓度(mol/L) 0.20 0.30 0.30
(1)利用反应的浓度和起始浓度计算转化率;
(2)依据反应速率v=
| △c |
| △t |
(3)同温同压下,物质的量与压强成正比,则利用反应前后的物质的量之和计算压强的比值;
(4)平衡时气体体积分数和物质的量分数相同;
(5)K为生成物浓度幂之积与反应物浓度幂之积的比.
解答:
解:10L密闭容器中加入5.0molSO2、4.5molO2,c(SO2)=0.50mol/L,c(O2)=0.45mol/L,经10min后反应达平衡时反应的SO2的浓度为0.30mol/L,
则 2SO2+O2?2SO3
起始浓度(mol/L) 0.50 0.45 0
变化浓度(mol/L) 0.30 0.15 0.30
平衡浓度(mol/L) 0.20 0.30 0.30
(1)10min内O2的转化率为
×100%=33.3%,答:10min内O2的转化率为33.3%;
(2)用SO2表示该反应的反应速率=
=0.03mol/L?min,答:平衡时二氧化硫的反应速率为0.03mol/L?min;
(3)同温同压下,物质的量与压强成正比,则容器内平衡时的压强与反应前压强之比为
=16:19,
答:容器内反应前与平衡时的压强之比为16:19;
(4)平衡时体系中SO3的百分含量(体积分数)=
×100%=37.5%,答:平衡时体系中SO3的百分含量为37.5%;
(5)平衡常数K=
=
=7.5L/mol,答:平衡常数K为7.5L/mol.
则 2SO2+O2?2SO3
起始浓度(mol/L) 0.50 0.45 0
变化浓度(mol/L) 0.30 0.15 0.30
平衡浓度(mol/L) 0.20 0.30 0.30
(1)10min内O2的转化率为
| 0.15mol/L |
| 0.45mol∥L |
(2)用SO2表示该反应的反应速率=
| 0.30mol/L |
| 10min |
(3)同温同压下,物质的量与压强成正比,则容器内平衡时的压强与反应前压强之比为
| (0.2+0.30+0.30)mol/L×10L |
| 5.0mol+4.5mol |
答:容器内反应前与平衡时的压强之比为16:19;
(4)平衡时体系中SO3的百分含量(体积分数)=
| 0.30mol/L×10L |
| (0.2mol/L+0.3mol/L+0.3mol/L)×10L |
(5)平衡常数K=
| c2(SO3) |
| c2(SO2)c(O2) |
| (0.3mol/L)2 |
| (0.2mol/L)2×0.3mol/L |
点评:本题考查化学平衡的计算,明确化学平衡的三段法计算格式及平衡常数的计算方法是解答本题的关键,注意利用平衡浓度计算平衡常数,题目难度中等.

练习册系列答案
相关题目
下列叙述正确的是( )
| A、含有弱酸根盐的水溶液一定显碱性 |
| B、室温下,pH相同、体积相同的氨水和氢氧化钠两种溶液分别加水稀释2倍后,两溶液的pH均减小,其中,稀释后的氢氧化钠的pH比氨水的小 |
| C、室温时,0.01 mol?L-1醋酸溶液的pH=2 |
| D、室温时,0.01 mol?L-1醋酸溶液中加入等体积等浓度的NaOH溶液后,所得溶液的pH=7 |
饮用水消毒剂有多种,其中杀菌力强且又不影响水质的是( )
| A、O3 |
| B、漂白粉 |
| C、苯酚 |
| D、氯气 |
能用勒夏特列原理解释的是( )
| A、红棕色的NO2,加压后颜色先变深后变浅 |
| B、工业上合成NH3反应使用催化剂 |
| C、实验室可以采用排饱和食盐水收集Cl2 |
| D、由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 |
在一定温度下的定容密闭容器中,表明反应:A(g)+2B(g)?C(g)+D(g)已达到平衡状态的是( )
| A、A、C、D的物质的量浓度相等 |
| B、混合气体的密度不再改变 |
| C、气体的总物质的量不再改变 |
| D、v(B)=2v(C) |
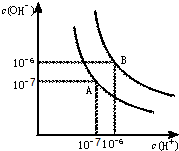 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.