题目内容
短周期某主族元素M的电离能情况如图所示.则M元素位于周期表的第 族.


考点:元素周期表的结构及其应用
专题:元素周期律与元素周期表专题
分析:由短周期某主族元素M的电离能可知,由第二电离能到第三电离能变化较大,则M最外层只有2个电子,以此来解答.
解答:
解:由短周期某主族元素M的电离能可知,由第二电离能到第三电离能变化较大,则M最外层只有2个电子,失去2个电子后为稳定结构,再失去1个电子需要的能量较大,所以该元素M为ⅡA元素,
故答案为:ⅡA.
故答案为:ⅡA.
点评:本题考查元素的电离能与最外层电子数,为高频考点,把握图中第二电离能到第三电离能变化较大为解答的关键,注意原子结构与失去电子关系,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
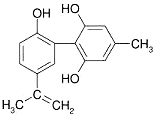 “人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是( )
“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如下图所示,有关该物质的说法正确的是( )| A、该分子中的碳原子均为不饱和碳原子 |
| B、滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
| C、1mol该物质分别与浓溴水和H2反应,最多消耗Br2和H2的物质的量分别为4mol、7mol |
| D、遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物 |
将PH=8的NaOH溶液与PH=10的NaOH溶液等体积混合后,溶液的PH值最接近( )
| A、8.3 | B、8.7 |
| C、9 | D、9.7 |
 A、B、C、D、E是中学常见的单质,X是化合物.A、B均为常见的金属,且在地壳中的含量分别为金属元素的前两位;常温下C是气态非金属单质,可以燃烧;D是空气主要成份之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
A、B、C、D、E是中学常见的单质,X是化合物.A、B均为常见的金属,且在地壳中的含量分别为金属元素的前两位;常温下C是气态非金属单质,可以燃烧;D是空气主要成份之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题: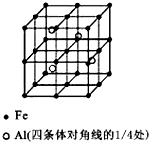 一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题:
一种Al-Fe合金的立体晶胞如图所示.请据此回答下列问题: