题目内容
分类法是人们认识事物时常用的科学方法.下列关于“Na2SO4”的分类错误的是( )
| A、属于氧化物 | B、属于硫酸盐 |
| C、属于钠盐 | D、属于电解质 |
考点:酸、碱、盐、氧化物的概念及其相互联系,电解质与非电解质
专题:
分析:A、氧化物时指两种元素组成,其中一种是氧元素的化合物;
B、阴离子为硫酸根的盐为硫酸盐;
C、含钠离子的盐为钠盐;
D、水溶液中或熔融状态导电的化合物为电解质.
B、阴离子为硫酸根的盐为硫酸盐;
C、含钠离子的盐为钠盐;
D、水溶液中或熔融状态导电的化合物为电解质.
解答:
解:A、氧化物时指两种元素组成,其中一种是氧元素的化合物,Na2SO4是三种元素组成,不符合概念,故A错误;
B、阴离子为硫酸根的盐为硫酸盐,故Na2SO4是硫酸盐,故B正确;
C、含钠离子的盐为钠盐,Na2SO4是由钠离子和硫酸根离子构成的盐,属于钠盐,故C正确;
D、水溶液中或熔融状态导电的化合物为电解质,K2SO4是由钾离子和硫酸根离子构成属于离子化合物水溶液中或熔融状态导电,是电解质,故D正确;
故选A.
B、阴离子为硫酸根的盐为硫酸盐,故Na2SO4是硫酸盐,故B正确;
C、含钠离子的盐为钠盐,Na2SO4是由钠离子和硫酸根离子构成的盐,属于钠盐,故C正确;
D、水溶液中或熔融状态导电的化合物为电解质,K2SO4是由钾离子和硫酸根离子构成属于离子化合物水溶液中或熔融状态导电,是电解质,故D正确;
故选A.
点评:本题考查了酸碱盐概念的分析应用,物质组成是判断的依据,掌握基础是关键,题目较简单.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
下列关于电解质溶液的叙述中正确的是( )
| A、Na2CO3、NaHCO3两种盐的溶液中,离子种类相同 | ||
| B、在CH3COONa溶液中c (CH3COO-)>c(Na+)>c(OH-)>c(H+) | ||
C、在0.1mol?L-1的醋酸溶液中加入适量的蒸馏水,溶液的
| ||
| D、常温下,某溶液中由水电离出的c(H+)为10-5 mol/L,则此溶液可能是盐酸 |
下列化学反应对应的离子方程式正确的是( )
| A、KOH溶液与KHSO4溶液反应:OH-+H+═H2O |
| B、稀H2SO4与Ba(OH)2溶液反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
| C、铁与盐酸反应:Fe+2H+═Fe3++H2↑ |
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
不合格建筑石材含有放射性的
Rn.该原子的中子数是( )
222 86 |
| A、50 | B、86 |
| C、136 | D、222 |
下列物质中,属于纯净物的是( )
①陶瓷,②水泥,③玻璃,④漂白粉,⑤胆矾,⑥氯水,⑦液氯.
①陶瓷,②水泥,③玻璃,④漂白粉,⑤胆矾,⑥氯水,⑦液氯.
| A、①③⑤ | B、②④⑥ |
| C、⑤⑦ | D、⑥⑦ |
具备基本的化学实验技能是进行科学探究的基础和保证.下列有关实验操作正确的是:( )
A、 点燃酒精灯 |
B、 称量固体 |
C、 液体加热 |
D、 量取液体 |
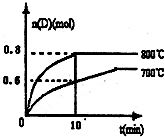 (1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1
(1)已知:N2(g)+O2(g)=2NO(g)△H=180.5kJ?mol-1