题目内容
6.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )| A. | 放电时锌做负极 | |
| B. | 充电时电池的正极和电源的正极相连 | |
| C. | 充电时氢氧化铁被氧化 | |
| D. | 放电时每转移3 mol e-,有2 mol FeO42-被还原 |
分析 由反应可知,放电时Zn为负极,电极方程式为Zn-2e-+2OH-=Zn(OH)2,K2FeO4在正极上发生还原反应,电极方程式为FeO42-+4H2O+3e-═Fe(OH)3+5OH-;充电时电池的正极与电源的正极相连为阳极,阳极发生氧化反应,充电时的反应为放电的逆反应,以此来解答.
解答 解:A.放电时,Zn失去电子,发生Zn-2e-+2OH-=Zn(OH)2,则放电时锌做负极,故A正确;
B.充电时电池的正极和电源的正极相连,作阳极,故B正确;
C.充电时Fe(OH)3失电子生成有KOH生成K2FeO4,Fe的化合价升高被氧化,故C正确;
D.放电时,Fe化合价由+6价降低为+3价,则放电时每转移3mol电子,正极有1molK2FeO4被还原,故D错误;
故选D.
点评 本题考查化学电源新型电池,明确信息中的总反应及放电为原电池反应、充电为电解池反应是解答本题的关键,注意发生的电极反应,题目难度中等.

练习册系列答案
相关题目
19.如图所示的实验或操作中,能达到实验目的是( )
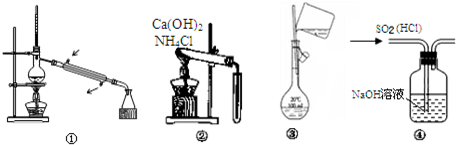

| A. | 图①常用于分离沸点不同且彼此互溶的液态混合物 | |
| B. | 图②可用于实验室制备并收集少量的NH3 | |
| C. | 图③表示的是实验室配制溶液转移过程 | |
| D. | 图④可用于除去SO2中的HCl气体 |
19.若20g密度为?dg•cm-3的Ca(NO3)2溶液中含有2g Ca2+,则溶液中NO3-的物质的量浓度为( )
| A. | 5?mol•L-1 | B. | 2.5?mol•L-1 | C. | ?d/400 mol•L-1 | D. | ?d/200mol•L-1 |
14.下列有关水的说法正确的是( )
| A. | 饮用水越纯净越好 | B. | 水是一种很好的溶剂 | ||
| C. | 没有污染的水就是纯净水 | D. | 水在人体内没有调节体温的作用 |
1.通常所说的三大材料是指金属材料、无机非金属材料和有机高分子材料.下述材料中全部属于金属材料的是( )
| A. | 玻璃、陶瓷、水泥 | B. | 塑料,合成纤维、橡胶 | ||
| C. | 青铜、碳素钢、硬铝 | D. | 玻璃钢、聚乙烯、超导陶瓷 |
11.当光束通过下列分散系时,能产生丁达尔效应的是( )
| A. | 食盐水 | B. | 浑浊的石灰水 | C. | 盐酸 | D. | 氢氧化铁胶体 |
18.某无色透明的强酸性溶液中,可能大量存在的离于组是( )
| A. | K+、SO42-、CO32- | B. | Al3+、Na+、NO3- | C. | NH4+、OH-、SO32- | D. | Ag+、Cu2+、HCO3- |
15.如图纵坐标代表沉淀的质量,横坐标代表加入溶液的体积,符合下列图象的是( )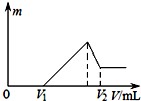

| A. | 向硫酸溶液中加入氢氧化钡溶液 | |
| B. | 向碳酸氢钠溶液中加入氯化钙 | |
| C. | 向硫酸、硫酸镁、硫酸铝的混合溶液中逐滴加入氢氧化钠溶液直至过量 | |
| D. | 向氯化铝溶液中加入过量氢氧化钠溶液 |
 2NO2(g)△H>0,反应达到平衡时,下列说法不正确的是( )
2NO2(g)△H>0,反应达到平衡时,下列说法不正确的是( )