题目内容
 如图中的四条线表示钠、镁、铝、铁分别和足量Cl2反应时,消耗金属的质量(纵轴)与参加反应的氯气质量(横轴)的关系,其中代表铁与氯气反应的是( )
如图中的四条线表示钠、镁、铝、铁分别和足量Cl2反应时,消耗金属的质量(纵轴)与参加反应的氯气质量(横轴)的关系,其中代表铁与氯气反应的是( )| A、a | B、b | C、c | D、d |
考点:化学方程式的有关计算
专题:
分析:根据等质量的氯气消耗金属的质量进行判断,可以假设氯气的物质的量为0.5mol.
解答:
解:Na、Mg、Al、Fe与Cl2反应分别生成NaCl、MgCl2、AlCl3、FeCl3,假设均有0.5 mol Cl2反应,则消耗金属的质量分别为23 g、12 g、9 g、18.7 g,即c代表铁,C项正确.
故选C.
故选C.
点评:本题考查学生金属和氯气之间的反应情况,注意解题方法的应用,难度不大.

练习册系列答案
相关题目
下列各组离子在溶液中能够大量共存的是( )
| A、NH4+、Ca2+、OH-、CO32- |
| B、NH4+、Br-、Na+、SO42- |
| C、Ag+、H+、SO32-、ClO- |
| D、H+、Cl-、Fe2+、NO3- |
下列用电子式表示的形成过程正确的是( )
A、H×+?Cl:→H+[
| ||||
B、Na×+?Br:→Na
| ||||
C、×Mg×+2?F:→Mg2+[
| ||||
D、 |
1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
| A、苯不能使溴水褪色 |
| B、苯能与H2发生加成反应 |
| C、溴苯没有同分异构体 |
| D、苯能燃烧 |
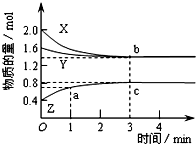 某温度时,在体积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8).下列说法中正确的是( )
某温度时,在体积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8).下列说法中正确的是( )| A、该反应的化学方程式是3X+Y=2Z |
| B、3 min时,X的转化率为70% |
| C、达平衡时,c(Y)=0.7 mol?L-1 |
| D、前1 min内,v(Z)=0.3 mol?L-1?min-1 |
 如图表示一个晶胞,该晶胞为正方体型,原子(或分子、离子)位于正方体的顶点和面心.试回答下列问题:
如图表示一个晶胞,该晶胞为正方体型,原子(或分子、离子)位于正方体的顶点和面心.试回答下列问题: