题目内容
 CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2?2H2O晶体,拟定实验步骤如图所示:请回答下列问题:
CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2?2H2O晶体,拟定实验步骤如图所示:请回答下列问题:(1)①步骤Ⅰ中,将Fe2+转化为Fe3+可选用下列氧化剂中的
A.K2Cr2O7B.NaClOC.氯水 D.溴水
②在上述四个选项中的NaClO是漂白液的有效成分.在强碱性条件下,NaClO与FeCl3反应可制取Na2FeO4,其反应的离子方程式为
(2)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的
A.NaOH B.Cu C.CuO D.Cu2(OH)2CO3
(3)在步骤Ⅲ中,要从溶液中制得纯净的CuCl2?2H2O晶体,应在通入
考点:难溶电解质的溶解平衡及沉淀转化的本质,物质的分离、提纯和除杂
专题:电离平衡与溶液的pH专题
分析:依据流程可知:Ⅰ是把溶液中亚铁离子氧化为铁离子便于除去;Ⅱ是调节pH值除去溶液中的铁离子;Ⅲ是制取目标产物;
(1)①根据需要,反应不能引进杂质离子,氯水是强氧化剂且不引进杂质,据此回答;
②依据氧化还原反应原理以及离子反应方程式的书写方法书写即可;
(2)调节溶液的酸度以促使Fe3+沉淀完全,但是铜离子不沉淀,加入的试剂可以和氢离子反应,但是不能引进杂质离子;
(3)氯化铜溶液中铜离子易水解,应该在酸性环境下进行操作,得到氯化铜晶体.
(1)①根据需要,反应不能引进杂质离子,氯水是强氧化剂且不引进杂质,据此回答;
②依据氧化还原反应原理以及离子反应方程式的书写方法书写即可;
(2)调节溶液的酸度以促使Fe3+沉淀完全,但是铜离子不沉淀,加入的试剂可以和氢离子反应,但是不能引进杂质离子;
(3)氯化铜溶液中铜离子易水解,应该在酸性环境下进行操作,得到氯化铜晶体.
解答:
解:(1)①A、B、C、D选项中的物质均具有强化性,能将亚铁离子氧化,但是氧化亚铁离子的同时不能引进杂质离子,故A、B、D错误,由于是氯化亚铁溶液,故利用氯水不会引进杂质离子,所以选C,故答案为:C;
②用FeCl3与NaClO在强碱性条件下反应制取Na2FeO4,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(2)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,但是铜离子不沉淀,加入的试剂可以和氢离子反应,但是不能引进杂质离子,可以是氧化铜、碱式碳酸铜,碳酸铜或是氢氧化铜等,故答案为:CD;
(3)氯化铜溶液中铜离子易水解,应该在酸性环境下,将溶液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,得到氯化铜晶体,
故答案为:HCl;蒸发浓缩;冷却结晶.
②用FeCl3与NaClO在强碱性条件下反应制取Na2FeO4,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O.
(2)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,但是铜离子不沉淀,加入的试剂可以和氢离子反应,但是不能引进杂质离子,可以是氧化铜、碱式碳酸铜,碳酸铜或是氢氧化铜等,故答案为:CD;
(3)氯化铜溶液中铜离子易水解,应该在酸性环境下,将溶液蒸发浓缩、冷却结晶,过滤、洗涤、干燥,得到氯化铜晶体,
故答案为:HCl;蒸发浓缩;冷却结晶.
点评:本题考查制备流程、流程步骤中的操作目的和反应现象、反应产物的分析判断,尾气的成分判断和处理方法,题目难度中等.

练习册系列答案
相关题目
下列与化学反应能量变化相关的叙述正确的是( )
| A、生成物总能量一定低于反应物总能量 |
| B、应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C、人类利用的能量都是通过化学反应获得的 |
| D、在化学反应中只有燃烧反应才能放出热量 |
下列有关化学用语表示正确的是( )
A、CH4分子的球棍模型: | ||
B、Cl-离子的结构示意图: | ||
C、氟化钠的电子式: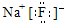 | ||
D、中子数为146、质子数为92 的铀原子
|
下列各组物质充分反应后,只能得到一种气体的是( )
| A、固体硝酸铜受热分解 |
| B、Na2O2与足量的稀硫酸反应 |
| C、木炭和浓硫酸共热 |
| D、足量的铜跟一定量的浓硝酸反应 |

