题目内容
10.某溶液中加人铝粉能产生氢气,则该溶液中肯定不能大量共存的离子组是( )| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、A13+、H+、Cl- | ||
| C. | NO3-、NH4+、K+、Cl- | D. | NO3-、K+、AlO2-、OH- |
分析 某溶液中加人铝粉能产生氢气,该溶液中存在大量氢离子或氢氧根离子,
A.铵根离子与氢氧根离子反应,碳酸根离子与氢离子反应;
B.四种离子之间不反应,都不与氢离子反应;
C.铵根离子与氢氧根离子反应,酸性条件下硝酸根离子具有强氧化性,与铝反应不会生成氢气;
D.四种离子之间不反应,都不与氢氧根离子反应.
解答 解:某溶液中加人铝粉能产生氢气,该溶液为酸性或强碱性溶液,溶液中存在大量氢离子或氢氧根离子,
A.NH4+与氢氧根离子反应,CO32-与氢离子反应,在溶液中一定不能大量共存,故A正确;
B.Na+、A13+、H+、Cl-之间不反应,都不与氢离子反应,在酸性溶液中能够大量共存,故B错误;
C.NH4+与氢氧根离子反应,NO3-在酸性条件下与铝反应不会生成氢气,在溶液中一定不能大量共存,故C正确;
D.NO3-、K+、AlO2-、OH-之间不反应,都不与氢氧根离子反应,在碱性溶液中能够大量共存,故D错误;
故选AC.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
20.二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
I、(1)合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,既要加快反应速率又要提高H2的转化率,可以采取的措施是D.
A、低温 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)保持其它条件不变,只改变下列条件能使H2的体积分数增大的是C.
A.使用高效催化剂 B.增大压强
C.升高温度 D.向容器中再充入1mol (CH3OCH3)和1molCO2
(3)在一定温度下,可以判断该分解反应已经达到化学平衡的是ABD.
A.V正(CO)﹕V逆(CO2)=3﹕1B.恒容密闭容器中总压强不变
C.恒容密闭容器中混合气体的密度不变D.密闭容器中氢气的体积分数不变
(4)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
403K时,该反应的平衡常数为400
Ⅱ、二甲醚燃料电池的工作原理如图一所示.
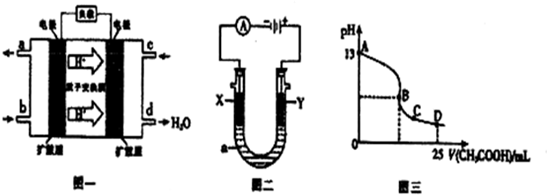
(1)该电池负极的电极反应式为CH3OCH3+3H2O-12e-=12H++2CO2.
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,两极共产生0.224L(标准状况下)气体时,溶液的pH为12.(忽略溶液的体积变化)
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在AB区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-).
I、(1)合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247KJ/mol
一定条件下该反应在密闭容器中达到平衡后,既要加快反应速率又要提高H2的转化率,可以采取的措施是D.
A、低温 B、加催化剂 C、体积不变充入N2
D、增加CO浓度 E、分离出二甲醚
(2)保持其它条件不变,只改变下列条件能使H2的体积分数增大的是C.
A.使用高效催化剂 B.增大压强
C.升高温度 D.向容器中再充入1mol (CH3OCH3)和1molCO2
(3)在一定温度下,可以判断该分解反应已经达到化学平衡的是ABD.
A.V正(CO)﹕V逆(CO2)=3﹕1B.恒容密闭容器中总压强不变
C.恒容密闭容器中混合气体的密度不变D.密闭容器中氢气的体积分数不变
(4)合成二甲醚反应二:2CH3OH(g)?CH3OCH3(g)+H2O(g).在不同温度下,分别在1L密闭容器中加入不同物质的量的CH3OH,反应达到平衡,测得各组分的浓度如表:‘
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| l | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
Ⅱ、二甲醚燃料电池的工作原理如图一所示.

(1)该电池负极的电极反应式为CH3OCH3+3H2O-12e-=12H++2CO2.
(2)以上述电池为电源,通过导线与图二电解池相连.X、Y为石墨,a为1L0.1mol/LKCl溶液,两极共产生0.224L(标准状况下)气体时,溶液的pH为12.(忽略溶液的体积变化)
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L 醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①若图三的B点pH=7,则滴定终点在AB区间(填“AB”、“BC”或“CD”).
②C点溶液中各离子浓度大小关系是c(CH3COO-)>c(K+)>c(H+)>c(OH-).
1.下列说法正确的是( )
| A. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| B. | 对苯二甲酸(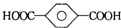 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (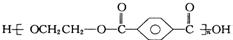 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
5.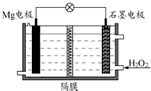 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )| A. | 电池工作时,石墨周围海水的pH减少 | |
| B. | 电池工作时,溶液中的H+向负极移动 | |
| C. | 电池总反应为Mg+H2O2+2H+═Mg2++2H2O | |
| D. | Mg电极是该电池的正极 |
15.我国规定饮用水质量标准必须符合下列要求:
以下是源水处理成自来水的工艺流程示意图:
源水→曝气池$\stackrel{加石灰}{→}$一级沉降池$→_{通入CO_{2}}^{凝聚剂井}$二级沉降池$\stackrel{气体A}{→}$过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式Mg2++OH-=Mg(OH)2↓.
(2)凝聚剂除去悬浮固体颗粒的过程③(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀.
(3)通入二氧化碳的目的是将Ca2+除去和调整溶液中的pH达到饮用水质量标准.
(4)气体A的作用是杀菌消毒.这种作用是基于气体A和水反应的产物具有强氧化性.
(5)下列物质中,①和③可以作为气体A的代用品.(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
| pH | 6.5~6.8 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/L |
源水→曝气池$\stackrel{加石灰}{→}$一级沉降池$→_{通入CO_{2}}^{凝聚剂井}$二级沉降池$\stackrel{气体A}{→}$过滤池→自来水
(1)源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式Mg2++OH-=Mg(OH)2↓.
(2)凝聚剂除去悬浮固体颗粒的过程③(填写编号,多选倒扣分)
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4.7H2O是常用的凝聚剂,它在水中最终生成Fe(OH)3沉淀.
(3)通入二氧化碳的目的是将Ca2+除去和调整溶液中的pH达到饮用水质量标准.
(4)气体A的作用是杀菌消毒.这种作用是基于气体A和水反应的产物具有强氧化性.
(5)下列物质中,①和③可以作为气体A的代用品.(填写编号,多选倒扣分)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2.
19.1mol甲烷和一定物质的量的氯气混合均匀,以漫射光照射使之发生取代反应.甲烷的取代反应所得有机产物都是很好的有机溶剂.假设反应后甲烷与氯气均无剩余,且生成了等物质的量的四种有机取代产物,则参加反应的氯气的物质的量为( )
| A. | 1.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
20.将0.51 mol铜与250 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L.待产生的气体全部释放后,向溶液中加入300 mL 5 mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀.则下列选项正确的是( )
| A. | 反应中转移电子1.0mol | B. | 产生NO2气体0.26mol | ||
| C. | 原HNO3浓度为8.0mol/L | D. | 原HNO3浓度为6.0mol/L |
 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.