题目内容
1.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.05mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH.则电解过程中转移的电子为( )| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3 mol | D. | 0.4 mol |
分析 碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,所以加入0.05mol碱式碳酸铜[Cu2(OH)2CO3]相当于加入0.1molCuO、0.05molH2O,根据生成物知,阴极上铜离子和氢离子放电、阳极上氢氧根离子放电,根据铜和氢气的物质的量与转移电子之间的关系式计算转移电子的物质的量.
解答 解:电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳,溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:
第一阶段2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,
第二阶段:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,
将碱式碳酸铜化学式改变为2CuO•H2O•CO2,所以加入0.05molCu2(OH)2CO3 就相当于加入0.1molCuO和0.05mol水,
第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.1mol,转移电子的物质的量=0.1mol×2=0.2mol;
第二阶段:电解生成0.1mol水转移电子的物质的量=0.05mol×2=0.1mol,
所以解过程中共转移的电子数为0.2mol+0.1mol=0.3mol,
故选:C.
点评 本题考查了电解原理,为高频考点,侧重考查学生的分析能力和计算能力,明确实际上加入的物质是解本题关键,再根据原子守恒、转移电子守恒来分析解答,难度中等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
4.工业上,可用如图所示装置来制取KIO3,则下列有关说法错误的是( )


| A. | 图中膜为阴膜(只允许阴离子通过),OH-从右往左通过该膜 | |
| B. | 电解时,阴极电极反应式为:2H++2e-═H2↑ | |
| C. | 电解时,如有3mol电子通过导线,则一定生成0.6mol KIO3 | |
| D. | 电池总反应为:KI+3H2O $\frac{\underline{\;电解\;}}{\;}$KIO3+3H2↑ |
12.实验室里可按如图所示的装置干燥、储存气体 R,多余的气体可用水吸收,则 R是( )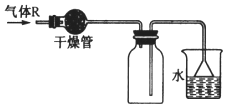

| A. | NO2 | B. | HCl | C. | SO2 | D. | NH3 |
9.化学与生活密切相关,下列说法错误的是( )
| A. | 食盐中加有碘,用其配成的溶液遇淀粉变蓝 | |
| B. | 厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大 | |
| C. | 使用氯气自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害 | |
| D. | 硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂. |
16.已知反应:
①2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-23.9kJ/mol
②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ/mol
③CH3CH2OH(g)═CH3OCH3(g)△H3=+50.7kJ/mol
在C2H4(g)+H2O(g)=CH3CH2OH(g)△H4中,△H4等于( )
①2CH3OH(g)?CH3OCH3(g)+H2O(g)△H1=-23.9kJ/mol
②2CH3OH(g)═C2H4(g)+2H2O(g)△H2=-29.1kJ/mol
③CH3CH2OH(g)═CH3OCH3(g)△H3=+50.7kJ/mol
在C2H4(g)+H2O(g)=CH3CH2OH(g)△H4中,△H4等于( )
| A. | -48.5kJ/mol | B. | +48.5kJ/mol | C. | -45.5kJ/mol | D. | +45.5kJ/mol |
6.下列关于氯离子的表示方法,错误的是( )
| A. | Cl- | B. |  | C. |  | D. |  |
13.对于某些离子的检验及结论一定正确的是( )
| A. | 加入硝酸银溶液产生白色沉淀,一定有Cl- | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |