题目内容
下列电子排布中,原子处于激发状态的是( )
| A、1s22s22p5 |
| B、1s22s22p6 |
| C、1s22s22p63s23p63d44s2 |
| D、1s22s22p63s23p63d34s2 |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:原子的核外电子排布符合基态原子核外电子填充的能级顺序和能量最低原理、泡利不相容原理及洪特规则,原子处于基态,否则为激发态,以此进行判断.
解答:
解:A.电子排布式为1s22s22p5符合能量最低原理,所以为基态,故A不选;
B.电子排布式为1s22s22p6符合能量最低原理,所以为基态,故B不选;
C.1s22s22p63s23p63d44s2为激发态,根据能量最低原理知,其基态应为s22s22p63s23p63d54s1,故C选;
D.电子排布式为1s22s22p63s23p63d34s2符合能量最低原理,所以为基态,故D不选;
故选:C.
B.电子排布式为1s22s22p6符合能量最低原理,所以为基态,故B不选;
C.1s22s22p63s23p63d44s2为激发态,根据能量最低原理知,其基态应为s22s22p63s23p63d54s1,故C选;
D.电子排布式为1s22s22p63s23p63d34s2符合能量最低原理,所以为基态,故D不选;
故选:C.
点评:本题考查原子核外电子的排布,侧重于激发态的判断,可根据能量最低原理进行判断,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
100℃时,下列各溶液中,离子的物质的量浓度关系正确的是( )
| A、pH=11的氨水中:c(OH-)=3.0mol?L-1 |
| B、呈中性的醋酸和醋酸钠的混合溶液中:c(Na+)=c(CH3COO-) |
| C、pH=2的稀盐酸中,c(H+)=c(Cl-) |
| D、pH=8的Na2SO3溶液中,c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) |
一定条件下,在容积为5L的密闭容器中发生反应:2SO2(g)+O2(g)?2SO3(g),半分钟后测得生成0.02mol SO3.在这段时间内O2的化学反应速率(mol?L-1?min-1)为( )
| A、0.004 |
| B、0.008 |
| C、0.016 |
| D、0.032 |
下列说法正确的是( )
A、按系统命名法,化合物 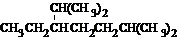 的名称为2,6-二甲基-5-乙基庚烷 的名称为2,6-二甲基-5-乙基庚烷 |
| B、等物质的量的乙烯、乙醇、丙烯酸分别充分燃烧,所耗用氧气的量相等 |
C、有机物 的分子式为C13H8O3,不可能所有原子共平面 的分子式为C13H8O3,不可能所有原子共平面 |
D、已知 ,反应物X与产物Y互为同分异构体,可用溴水反应加以分离 ,反应物X与产物Y互为同分异构体,可用溴水反应加以分离 |
在一定条件下,将E(g)和F(g)充入体积不变的2L密闭容器中,发生下述反应,并于5min末达到平衡:2E(g)+F(g)?2G(g).有关数据如表,下列判断正确的是( )
| E(g) | F(g) | G(g) | |
| 初始浓度(mol?L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol?L-1) | c1 | c2 | 0.4 |
| A、反应在前5min内,v(E)=0.04 mol/(L?min) |
| B、其他条件不变,若增大E的浓度,则达平衡时E的转化率会增大 |
| C、其他条件不变,降低温度,平衡时n(E)=3.0mol,则反应的△H>0 |
| D、平衡后移走2.0mol E和1.0mol F,在相同条件下再达平衡时,c(G)<0.2 mol?L-1 |
下列物质属于纯净物的是( )
| A、乙酸乙酯 | B、煤 |
| C、石油 | D、天然气 |
明矾石的主要成分为碱性硫酸铝钾KAl3(SO4)2(OH)6,可用于炼铝、净水等,焙烧碱性硫酸铝钾和硫的混合物,其反应为4KAl3(SO4)2(OH)6+3S=2K2SO4+6Al2O3+9SO2↑+12H2O.下列说法正确的是( )
| A、当生成6mol H2O时,转移的电子数为6NA |
| B、K2SO4为氧化产物,SO2为还原产物 |
| C、焙烧后的固体产物不能完全溶于NaOH溶液 |
| D、反应中体现氧化性的硫元素与体现还原性的硫元素的质量比为8:3 |
 在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是( )
在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是( )| A、100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液恰好中和后,所得溶液的pH等于7 |
| B、25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl溶液等体积混合,所得溶液的pH等于7 |
| C、25℃时,0.2 mol/L NaOH溶液与0.2 mol/L乙酸溶液恰好中和,所得溶液的pH等于7 |
| D、25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH大于7 |
 茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )