题目内容
18.设NA为阿伏加德罗常数值,下列说法正确的是( )| A. | 在常温下,0.3mol NaHSO4固体中含有的离子数目为0.6NA | |
| B. | 2L0.1mol•L-1Al2(SO4)3溶液中,Al3+的目为0.4NA | |
| C. | 标准状况下,4.48L O2所含有的共用电子对数目为0.2NA | |
| D. | 0.3mol Na2O2与盐酸反应,转移的电子数为0.6NA |
分析 A、NaHSO4固体由钠离子和硫酸氢根构成;
B、铝离子是弱碱阳离子,在溶液中会水解
C、求出氧气的物质的量,然后根据1mol氧气中含2mol共用电子对来分析;
D、过氧化钠与盐酸的反应为歧化反应.
解答 解:A、NaHSO4固体由钠离子和硫酸氢根构成,故1mol硫酸氢钠中含2mol离子即2NA个,故A正确;
B、铝离子是弱碱阳离子,在溶液中会水解,故溶液中的铝离子的个数小于0.4NA个,故B错误;
C、标况下4.48L氧气的物质的量为0.2mol,而1mol氧气中含2mol共用电子对,故0.2mol氧气中含0.4mol共用电子对即0.4NA对,故C错误;
D、过氧化钠与盐酸的反应为歧化反应,氧元素的价态由-1价变为0价、-1价变为-2价,故0.3mol过氧化钠转移0.3mol电子即0.3NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 能使含NH4+的溶液放出NH3的溶液:Na+、Mg2+、SO42-、Cl- | |
| B. | 1.0mol•L-1的NaNO3的溶液:H+、Cu2+、I-、SO42- | |
| C. | $\frac{{K}_{W}}{c({OH}^{-})}$=0.001mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| D. | FeCl3溶液:NH4+、Mg2+、SO42-、NO3- |
9.某溶液中存在大量的OH-、Na+、SO42-,该溶液中还可能大量存在的离子是( )
| A. | Al3+ | B. | Ba2+ | C. | NH4+ | D. | CO32ˉ |
6.下列关于氮的固定的说法错误的是( )
| A. | 氮的固定包括人工固氮和自然固氮 | B. | 工业合成氨属于人工固氮 | ||
| C. | 自然固氮中氮元素被氧化 | D. | 氮的固定中参与元素至少有两种 |
3.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )
| A. |  火法炼铜 | B. |  粘土制陶瓷 | C. |  树皮造纸 | D. |  打磨磁石制 |
10.常温下,1mol化学键形成(或断裂)的能量变化用E表示.根据表中信息判断,下列说法正确的是( )
| 共价键 | H-H | Cl-Cl | H-Cl |
| E (kJ •mol-1) | 436 | 243 | 432 |
| A. | H2(g)+Cl2(g)=2HCl (g)△H=+247 kJ•mol-1 | |
| B. | H (g)+Cl (g)→HCl (g)△△H=+432 kJ•mol-1 | |
| C. | 1 mol H2(g) 与1 mol Cl2(g) 的总能量高于2 mol HCl (g) 的总能量 | |
| D. | 用电子式表示HCl的形成过程 |
7.下列关于离子检验的叙述正确的是( )
| A. | 向FeCl2、NaI的混合溶液中加入硫氰化钾溶液,再滴加少量氯水,溶液没有变为红色,说明还原性:Fe2+<I- | |
| B. | 检验AlNH4(SO4)2溶液中的NH4+:取样于试管中,向溶液中加入少量NaOH溶液,加热,用湿润的红色石蕊试纸检验产生的气体 | |
| C. | 检验Na2SO3和Na2SO4的混合溶液中的SO42-:先加足量稀硝酸,再加氯化钡溶液 | |
| D. | 验证碳酸钠溶液显碱性是CO32-导致的:先加酚酞试液,溶液变红,再加硫酸溶液,红色褪去 |


 .
. .
. .
. .
.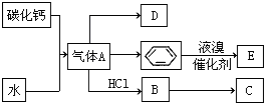 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: ;C的结构简式
;C的结构简式 ;
; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr;其反应类型为取代反应.
+HBr;其反应类型为取代反应.