题目内容
16. 面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.(1)直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2,在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是2OH-+SO2═SO32-+H2O.
(2)用甲醇替代作为汽车燃料可降低汽车尾气污染.已知用合成气(CO和H2)合成1mol液态甲醇吸收热量为131.9kJ,4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kJ/mol,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1452kJ/mol.
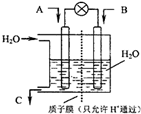
(3)现欲以如图所示装置用电化学原理将CO2、SO2转化为重要化工原料.
①若A为CO2,B为H2,C为CH3OH,则通入H2的一极为负极.
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
(4)①已知:密闭容器中,17℃、1.01×105Pa条件下,2NO2(g)?N2O4(g)△H<0的平衡常数K=13.3.当此反应达到平衡时,若c(NO2)=0.030mol/L,则c(N2O4)=0.012mol/L(保留两位有效数字).
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中c(NO2)=0.04mol/L,c(N2O4)=0.007mol/L,则改变的条件是升高温度.
分析 (1)二氧化硫与过量的氢氧化钠反应生成亚硫酸钠和水;
(2)已知合成液态甲醇的热化学方程式为:CO(g)+2H2(g)=CH3OH(l)△H=+131.9kJ/mol,又已知4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kJ/mol;利用盖斯定律可求出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式;
(3)①H2失去电子,故H2的一极为负极;
②SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+;
(4)①K=$\frac{c(N2O4)}{C2(NO2)}$=13.3,再根据c(NO2)=0.030mol/L,可求出c(N2O4);
②改变上述体系的某个条件,达到新的平衡后,根据c(NO2)和c(N2O4)求出K值,K减小,说明升高了温度,平衡逆向移动.
解答 解:(1)二氧化硫与氢氧化钠反应的离子方程式:2OH-+SO2═SO32-+H2O,故答案为:2OH-+SO2═SO32-+H2O;
(2)已知合成液态甲醇的热化学方程式为:CO(g)+2H2(g)=CH3OH(l)△H=+131.9kJ/mol,又已知4H2(g)+2CO(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-1188.2kJ/mol;利用盖斯定律可求出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1452kJ/mol,
故答案为:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1452kJ/mol;
(3)①H2失去电子,故H2的一极为负极,故答案为:负;
②SO2在负极失去电子转化为SO42-,故其电极反应为:SO2+2H2O-2e-=SO42-+4H+,故答案为:SO2+2H2O-2e-=SO42-+4H+;
(4)①K=$\frac{c(N2O4)}{C2(NO2)}$=13.3,再根据c(NO2)=0.030mol/L,可求出c(N2O4)=0.012mol/L,故答案为:0.012mol/L;
②改变上述体系的某个条件,达到新的平衡后,根据c(NO2)和c(N2O4)求出K=4.375,K减小,说明升高了温度,平衡逆向移动,故答案为:升高温度.
点评 本题属于拼合型题目,涉及热化学方程式书写、反应热计算、化学平衡有关计算及影响因素、电解池等,侧重考查学生对知识的迁移应用,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 钢 | B. | 液氯 | C. | 玻璃 | D. | 氨水 |
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)表中能形成两性氢氧化物的元素在周期表中的位置是第三周期第ⅢA族,写出该元素的最高价氧化物对应的水化物与⑨最高价氧化物的水化物反应的化学方程式KOH+Al(OH)3═KAlO2+2H2O.
(3)用电子式表示④元素与⑦元素形成化合物的过程
 .
.(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是HClO4(填酸的化学式).
(5)④⑤两元素相比较,金属性较强的是镁(填名称),可以验证该结论的实验是bc.(填编号)
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质分别和热水作用,并滴入酚酞
(d)比较这两种元素的气态氢化物的稳定性
(6)⑥和⑦阴离子还原性较强的是(填微粒符号):S2-用一个置换反应证实这一结论(写化学方程式)Cl2+Na2S═2NaCl+S↓
(7)③⑦⑩三种元素的气态氢化物沸点由高到低的顺序为HF>HBr>HCl(写化学式),氢化物酸性由弱到强的顺序为HF<HCl<HBr(写化学式)
| A. | 埋在潮湿土壤里的铁管比在干燥土壤中的更易被腐蚀 | |
| B. | 在空气中,金属镁、铝的表面可形成一层氧化膜 | |
| C. | 为保护海轮的船壳,常在海轮上镶嵌锌块 | |
| D. | 镀锡的铁制品,镀层部分破坏后,露出的铁表面更容易被腐蚀 |
| A. | CuCl2(CuO) | B. | NaOH(NaOH) | C. | CuSO4(CuO) | D. | NaCl(盐酸) |
| A. | Cl2 | B. | Cl2O | C. | Cl2O3 | D. | ClO2 |
| A. | 苯酚遇石蕊显红色 | B. | 包装用材料聚氯乙烯属于烃 | ||
| C. | 食用花生油能发生水解反应 | D. | PX项目中的对二甲苯属于饱和烃 |
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 标准状况下,4.0 g CH4中含有共价键的数目为NA |