题目内容
1.实验室里将NaClO3和Na2SO3按质量之比71:168倒入烧瓶中,同时滴入适量H2SO4并用水浴加热,产生棕黄色的气体X,实验测得NaClO3和Na2SO3恰好完全反应.则X为( )| A. | Cl2 | B. | Cl2O | C. | Cl2O3 | D. | ClO2 |
分析 n(NaClO3):n(Na2SO3)=$\frac{71g}{106.5g/mol}$:$\frac{168g}{126g/mol}$=1:2,二者发生氧化还原反应,S元素的化合价升高,Cl元素的化合价降低,结合电子守恒计算.
解答 解:n(NaClO3):n(Na2SO3)=$\frac{71g}{106.5g/mol}$:$\frac{168g}{126g/mol}$=1:2,二者发生氧化还原反应,S元素的化合价升高,Cl元素的化合价降低,
设X中Cl元素的化合价为x,
由电子守恒可知,1×(5-x)=2×(6-4),
解得x=+1价,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,注意从化合价变化判断氧化剂、还原剂、氧化产物、还原产物等概念,明确电子转移守恒为计算的关键,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
12.一定量的稀硫酸与足量的铝粉反应时,为了减缓反应速率,且不影响生成氢气的总量,应向稀硫酸中加入适量的( )
| A. | NaOH(固体) | B. | CH3COOH | C. | NaCl(固体) | D. | CH3COONa(固体) |
9.下列图中的实验方案,能达到实验目的是( )
| 实 验 方 案 | 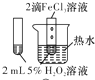 | 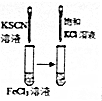 | 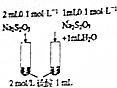 | 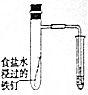 |
| 目 的 | A.验证升高温度可加快H2O2分解 | B.探究增大c(Cl-使平衡逆向移动 | C.探究浓度对化学反应速率的影响 | D.验证铁发生析氢腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
6.下列关系的比较,对应正确的是( )
| A. | 氧化性:Na+>H+>Cu2+ | |
| B. | 还原性:Cl->S2->O2- | |
| C. | 等质量时的耗氧量:C2H6>CH4>C6H6 | |
| D. | 与金属钠反应的剧烈程度:C2H5OH<H2O |
10.小伶想调查一下国兴中学污水排放的情况,她于是从下水道中提取了一瓶水样,静置后发现取得的水样出现分层,上层为油状物,下层悬浮着各种固体杂质.你认为最先进行的两步处理应该是( )
| A. | 蒸发、结晶 | B. | 过滤、分液 | C. | 过滤、蒸馏 | D. | 萃取、分液 |
11.下列说法不正确的是( )
| A. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,它们互为同分异构体 | |
| C. | “地沟油”可通过水解制得肥皂 | |
| D. | 苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
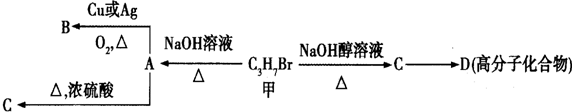
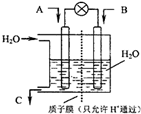 面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.