题目内容
18.关于下列各装置图的叙述中,正确的是( )
| A. | ①中,d极发生氧化反应、c极发生还原反应 | |
| B. | ②中从a口通入气体,可用于收集H2、NH3、CH4等气体 | |
| C. | ③中X若为CCl4,上层为稀硫酸,可用于吸收氨气,并防止倒吸 | |
| D. | ④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
分析 A.图中电流方向判断电源a为正极,b为负极,c为阳极,d为阴极,原电池中负极发生氧化反应,电解池中阳极发生氧化反应;
B.装置分析可知,a进b出是用于收集比空气轻的气体且不和空气中气体发生反应;
C.氨气和稀硫酸发生反应,氨气在四氯化碳中不溶解不反应,可以吸收氨气防止倒吸;
D.碱石灰可以吸收氯化氢,氯化氢比空气重.
解答 解:A.图中电流方向判断电源a为正极,b为负极,c为阳极,d为阴极,原电池中负极发生氧化反应,电解池中阳极发生氧化反应,d极发生还原反应、c极发生氧化反应,故A错误;
B.装置分析可知,a进b出是用于收集比空气轻的气体且不和空气中气体发生反应,可用于收集H2、NH3、CH4等比空气轻且不和空气中氧气反应的气体,故B错误;
C.氨气和稀硫酸发生反应,氨气在四氯化碳中不溶解不反应,可以吸收氨气防止倒吸,装置可用于吸收氨气,并防止倒吸,故C正确;
D.碱石灰可以吸收氯化氢,收集装置也错误,故D错误;
故选C.
点评 本题考查了原电池、电解池原理、电极反应、气体收集、气体吸收等实验基本操作,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
8.如图1所示是实验室中制取气体的一种简易装置.
(1)请简述检验它的气密性的方法关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好.
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)不溶于水的块状固体、不需要加热而反应生成的气体.
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.

(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为2.95mol/L(计算结果保留两位小数).用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和量筒.
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH$\stackrel{高温}{→}$2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是d.
a.HNO3的氧化性比KNO3弱 b.反应的温度不够
c.HNO3的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等.请设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
(1)请简述检验它的气密性的方法关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好.
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)不溶于水的块状固体、不需要加热而反应生成的气体.
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.

(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为2.95mol/L(计算结果保留两位小数).用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和量筒.
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH$\stackrel{高温}{→}$2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是d.
a.HNO3的氧化性比KNO3弱 b.反应的温度不够
c.HNO3的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等.请设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
9.出土的铜器文物表面有一层绿色的铜锈,铜锈的主要成分是( )
| A. | 碱式碳酸铜 | B. | 碳酸铜 | C. | 氢氧化铜 | D. | 氧化铜 |
6.经过长时间的努力已经可以解决部分的污染问题,例如可降解塑料的问世,聚二氧化碳塑料就是其中的佼佼者,有关聚二氧化碳塑料的说法正确的是( )
| A. | 聚二氧化碳塑料是通过缩聚反应生成的 | |
| B. | 聚二氧化碳塑料的结构式可表示为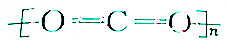 | |
| C. | 聚二氧化碳塑料属于纯净物,相对分子质量为44n | |
| D. | 聚二氧化碳塑料是属于环境友好材料 |
13.氨气与氧气在有催化剂的条件下进行反应,不会发生的现象是( )
| A. | 产生的气体溶于水中,能使酚酞变红 | |
| B. | 催化剂保持红热 | |
| C. | 可能生成红棕色的气体 | |
| D. | 可能产生白烟 |
20.如图为通过手持技术实时测量冰醋酸稀释过程中电导率和温度的变化曲线,下列关于弱电解质溶液电离过程的说法错误的是( )
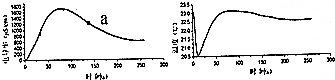

| A. | 冰醋酸稀释过程中,溶液的导电能力先增大后减小 | |
| B. | 左图的曲线也可以表示溶液的pH变化趋势 | |
| C. | 稀释一开始,溶液的温度就下降,可推知电离过程可能是吸热过程 | |
| D. | 可通过微热的方法,使图中a点溶液中的c(CH3COO-)增大 |
1.下列说法或表示方法不正确的是( )
| A. | 盖斯定律实质上是能量守恒定律的体现 | |
| B. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量大于57.3 kJ | |
| C. | 由C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知石墨比金刚石稳定 | |
| D. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ/mol |
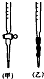 某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol•L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL.