题目内容
1.(1)0.5mol Al含有3.01×1023个铝原子,质量是13.5g;2.107×1024个铝原子是3.5mol Al,质量为94.5g.(2)0.2mol SO2气体中含有的分子数为1.204×1023,含有的原子数为3.612×1023,其质量为12.8g.
分析 (1)根据N=nNA计算Al原子数目,根据m=nM计算铝的质量;根据n=$\frac{N}{{N}_{A}}$计算Al的物质的量,根据m=nM计算铝的质量;
(2)根据N=nNA计算SO2分子数目,含有原子数目为SO2分子的3倍,根据m=nM计算SO2的质量.
解答 解:(1)0.5mol Al含有铝原子数目为0.5mol×6.02×1023mol-1=3.01×1023,质量是0.5mol×27g/mol=13.5g;2.107×1024个铝原子物质的量为$\frac{2.107×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=3.5mol,质量为3.5mol×27g/mol=94.5g,
故答案为:3.01×1023;13.5;3.5;94.5;
(2)0.2mol SO2气体中含有的分子数为0.2mol×6.02×1023mol-1=1.204×1023,含有的原子数为 1.204×1023×3=3.612×1023,其质量为0.2mol×64g/mol=12.8g,
故答案为:1.204×1023;3.612×1023;12.8.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的掌握.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
11.下列离子方程式书写正确的是( )
| A. | 氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 氢氧化铝与盐酸:Al(OH)3+3H+═Al3++3H2O | |
| C. | 铁溶于氯化铁溶液:Fe+Fe3+═2Fe2+ | |
| D. | 氨气溶于醋酸:H++NH3═NH4+ |
12.为了配制100mL 1mol•L-1的NaOH溶液,其中有下列几个操作:①NaOH固体放在纸上进行称量 ②选刚用蒸馏水洗净的100mL容量瓶进行配制 ③NaOH在烧杯里刚好完全溶解,立即把溶液转移到容量瓶中 ④用蒸馏水洗涤烧杯内壁和玻璃棒2次,洗涤液也均转入容量瓶中 ⑤使蒸馏水沿玻璃棒注入容量瓶,直到溶液的凹液面恰好与刻度线相切.其中错误的是( )
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤ | D. | ①③⑤ |
9.下列叙述中,错误的是( )
| A. | 利用电化学原理保护金属的一种方法是把被保护金属作为阳极,而另一比其更活泼的金属作为阴极 | |
| B. | 某一定条件下自发的化学反应,若△S<0,则该自发反应一定为放热反应 | |
| C. | 改变条件,使化学平衡往正向移动,反应物的转化率不一定增大 | |
| D. | 对于反应2NH3(g)?N2(g)+3H2(g),减小体积增大压强,反应物活化分子数及活化分子百分数均不发生改变 |
6.常温下,将pH=8和pH=10的两强碱溶液等体积混合,则混合溶液的pH为( )
| A. | 8.3 | B. | 9 | C. | 9.7 | D. | 无法确定 |
13.NPG的结构式如图,有关NPG说法错误的是( )


| A. | NPG与乙二醇互为同系物 | |
| B. | 1mol该醇与足量的钠反应放出1mol H2 | |
| C. | NPG一定条件下能发生取代反应、酯化反应、氧化反应、加成反应、加聚反应 | |
| D. | 分子式为C5H12O2 |

 C.CH3CH═CHCH2OH D.
C.CH3CH═CHCH2OH D.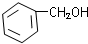
 .
.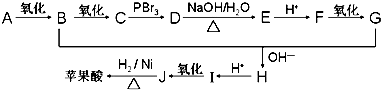


 +n HO-CH2CH2-OH$\stackrel{一定条件}{→}$
+n HO-CH2CH2-OH$\stackrel{一定条件}{→}$ +(2n-1)H2O
+(2n-1)H2O 、
、 .
.