题目内容
(1)已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1 2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1 写出TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: .
(2)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是:
A.CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ?mol-1
B.CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H=-676.7kJ?mol-1
由上述方程式可知,CH3OH的标准燃烧热 (填“大于”“等于”“小于”或“不能确定”)-676.7kJ?mol-1.已知水的气化热为44kJ?mol-1,则氢气燃烧的热化学方程式为 .
(2)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是:
A.CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ?mol-1
B.CH3OH(g)+
| 3 |
| 2 |
由上述方程式可知,CH3OH的标准燃烧热
考点:有关反应热的计算,热化学方程式
专题:化学反应中的能量变化
分析:(1)已知TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1,2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,根据盖斯定律计算分析得到;
(2)燃烧热是指可燃物完全燃烧生成稳定的氧化物所放出的热量,应生成液态水,而气态水变为液态水要放出热量,可利用盖斯定律计算反应热.
(2)燃烧热是指可燃物完全燃烧生成稳定的氧化物所放出的热量,应生成液态水,而气态水变为液态水要放出热量,可利用盖斯定律计算反应热.
解答:
解:(1)①TiO2 (s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140kJ?mol-1
②2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ?mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ?mol-1;
(2)燃烧热是指可燃物完全燃烧生成稳定的氧化物所放出的热量,应生成液态水,而气态水变为液态水要放出热量,由以上热化学方程式可以看出,当生成气态水时放出的热量为676.7kJ,则生成液态水应放出更多的热量,所以CH3OH的标准燃烧热小于-676.7kJ?mol-1;
已知:A.CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ?mol-1
B.CH3OH(g)+
O2(g)═CO2(g)+2H2O(g)△H=-676.7kJ?mol-1
利用盖斯定律将B-A可得:
O2(g)+3H2(g)=3H2O(g)△H=-725.7kJ/mol
即
O2(g)+H2(g)=H2O(g)△H=-241.9kJ/mol
又知:H2O(g)=H2O(l)△H=-44kJ/mol
则有:H2(g)+
O2(g)=H2O(l)△H=-(241.9+44)kJ/mol=-285.9kJ/mol,
故答案为:小于;H2(g)+
O2(g)═H2O(l)△H=-285.9 kJ?mol-1.
②2C(s)+O2(g)═2CO(g)△H=-221kJ?mol-1
依据盖斯定律①+②得到:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ?mol-1;
故答案为:TiO2(s)+2C(s)+2Cl2(g)═TiCl4(l)+2CO(g)△H=-81kJ?mol-1;
(2)燃烧热是指可燃物完全燃烧生成稳定的氧化物所放出的热量,应生成液态水,而气态水变为液态水要放出热量,由以上热化学方程式可以看出,当生成气态水时放出的热量为676.7kJ,则生成液态水应放出更多的热量,所以CH3OH的标准燃烧热小于-676.7kJ?mol-1;
已知:A.CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ?mol-1
B.CH3OH(g)+
| 3 |
| 2 |
利用盖斯定律将B-A可得:
| 3 |
| 2 |
即
| 1 |
| 2 |
又知:H2O(g)=H2O(l)△H=-44kJ/mol
则有:H2(g)+
| 1 |
| 2 |
故答案为:小于;H2(g)+
| 1 |
| 2 |
点评:本题考查化学反应与能量的有关计算,题目难度中等,注意利用盖斯定律计算反应热,侧重于考查学生对基础知识的应用能力.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
分子式为C5H11Cl的有机物分子中,所含的甲基数不可能为( )
| A、1 | B、2 | C、3 | D、4 |
 的异构体共有7种.其中3种是
的异构体共有7种.其中3种是 ,请写出其他4种的结构简式.
,请写出其他4种的结构简式.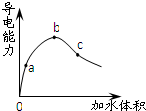 常温下,将一定量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.
常温下,将一定量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.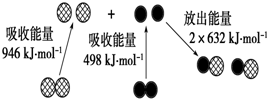 (1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.如图为N2(g)和O2(g)生成NO (g)过程中的能量变化:
(1)化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致.如图为N2(g)和O2(g)生成NO (g)过程中的能量变化: