题目内容
5.写出下列反应的方程式:(1)乙醇与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,属于反应置换反应;
(2)乙醇燃烧:C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O,属于反应氧化反应;
(3)乙醇的催化氧化:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O,属于反应氧化反应.
分析 (1)乙醇与与金属钠反应生成乙醇钠和氢气,断开羟基上的氢氧键,属于钠置换羟基上的氢;
(2)乙醇燃烧生成二氧化碳和水,该反应属于氧化反应;
(3)乙醇催化氧化生成乙醛和水,有机物得到氧或失去氢的反应为氧化反应.
解答 解:(1)乙醇与与金属钠反应生成乙醇钠和氢气,断开羟基上的氢氧键,反应方程式为2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,属于置换反应,
故答案为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;置换反应;
(2)乙醇燃烧生成二氧化碳和水,反应的化学方程式为:C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O,物质和氧发生的反应属于氧化反应,
故答案为:C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O;氧化反应;
(3)乙醇催化氧化,醇羟基被氧化成醛基,生成乙醛,反应为2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O,有机物得到氧或失去氢的反应为氧化反应,CH3CH2OH得到了氧同时失去氢,所以是氧化反应,
故答案为:2C2H5OH+O2$→_{△}^{Cu或Ag}$2CH3CHO+2H2O;氧化反应.
点评 本题考查化学反应方程式的书写,侧重有机物乙醇官能团醇羟基性质的考查,明确反应的条件及反应产物是解答的关键,并注意反应方程式的配平,题目难度不大.

练习册系列答案
相关题目
15.研究发现,NO在人体的血管系统内具有传送信号的功能,因而有“信使分子”的誉称.下列有关NO的说法正确的是( )
| A. | NO不属于大气污染物 | B. | NO能溶于水 | ||
| C. | NO易与空气中的氧气化合 | D. | NO可用排空气法收集 |
16.镍电池广泛应用于混合动力汽车系统,电极材料由NiO2、Fe和碳粉涂在铝箔上制成.放电过程中产生Ni(OH)2和Fe(OH)2,Fe(OH)2最终氧化、脱水生成氧化铁.由于电池使用后电极材料对环境有危害,某学习小组对该电池电极材料进行回收研究.
已知:①NiO2有强氧化性,可与浓盐酸反应;
②NiCl2易溶于水,Fe3+不能氧化Ni2+.
③某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
回答下列问题:
(1)该电池的正极反应式为;NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)维持电流强度为1.0A,消耗0.28gFe,理论电池工作965s.(已知F=96500C/mol)
(3)对该电池电极材料进行回收方案设计:
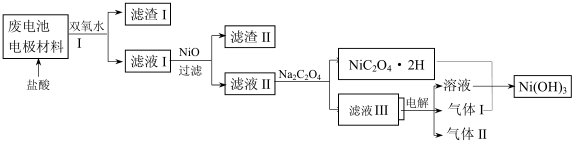
①方案中加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+;,;将混合物加入氢氧化钠溶液充分溶解、过滤、洗涤得到滤渣为氢氧化铁,将滤液中通入过量二氧化碳气体过滤洗涤得到沉淀氢氧化铝;在滤液I中慢慢加入NiO固体,则依次析出沉淀Fe(OH)3和沉淀Al(OH)3(填化学式).若两种沉淀都析出,pH应控制在不超过6.4(离子浓度小于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.4);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
②滤液III中溶质的主要成分是NaCl(填化学式);气体I为Cl2,判断依据是电解池阳极产生Cl2将NiC2O4氧化为Ni(OH)3.
已知:①NiO2有强氧化性,可与浓盐酸反应;
②NiCl2易溶于水,Fe3+不能氧化Ni2+.
③某温度下一些金属氢氧化物的Ksp及开始沉淀和完全沉淀时的理论pH如表所示:
| M(OH)n | Ksp | pH | |
| 开始沉淀 | 沉淀完全 | ||
| Al(OH)3 | 2.0×10-32 | 4.1 | - |
| Fe(OH)3 | 3.5×10-38 | 2.2 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Ni(OH)2 | 6.5×10-18 | 6.4 | 8.4 |
(1)该电池的正极反应式为;NiO2+2H2O+2e-=Ni(OH)2+2OH-;
(2)维持电流强度为1.0A,消耗0.28gFe,理论电池工作965s.(已知F=96500C/mol)
(3)对该电池电极材料进行回收方案设计:

①方案中加入适量双氧水的目的是将溶液中的Fe2+氧化为Fe3+;,;将混合物加入氢氧化钠溶液充分溶解、过滤、洗涤得到滤渣为氢氧化铁,将滤液中通入过量二氧化碳气体过滤洗涤得到沉淀氢氧化铝;在滤液I中慢慢加入NiO固体,则依次析出沉淀Fe(OH)3和沉淀Al(OH)3(填化学式).若两种沉淀都析出,pH应控制在不超过6.4(离子浓度小于1×10-5mol/L为完全沉淀,lg2=0.3、lg3=0.4);设计将析出的沉淀混合物中的两种物质分离开来的实验方案将混合物加入NaOH溶液中充分溶解,过滤、洗涤,滤渣为Fe(OH)3,将滤液通入足量CO2,过滤、洗涤,得沉淀物Al(OH)3.
②滤液III中溶质的主要成分是NaCl(填化学式);气体I为Cl2,判断依据是电解池阳极产生Cl2将NiC2O4氧化为Ni(OH)3.
13.化学科学需要借助化学语言来描述.下列化学用语正确的是( )
| A. | 甲烷分子的球棍模型: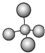 | |
| B. | $\underset{\stackrel{1}{\;}}{1}\underset{\stackrel{\;}{H}}{\;}$、$\underset{\stackrel{2}{\;}}{1}\underset{\stackrel{\;}{H}}{\;}$为同素异形体 | |
| C. | 离子结构示意图 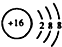 可以表示32S2-,又可以表示34S2- 可以表示32S2-,又可以表示34S2- | |
| D. | 中子数为146、质子数为92的铀(U)原子 14692U |
20.下列关系不正确的是( )
| A. | 离子半径:Cl->F->Na+>Al3+ | B. | 非金属性:Cl>S>P>Si | ||
| C. | 酸性:H2SiO3>H2CO3>H3PO4 | D. | 热稳定性:PH3<H2S<HCl<HF |
10.溴乙烷与氢氧化钾溶液共热,既可生成乙烯又可生成乙醇,下列说法正确的是( )
| A. | 生成乙烯的是氢氧化钾的水溶液 | B. | 生成乙醇的是氢氧化钾的水溶液? | ||
| C. | 生成乙烯的是在170℃下进行的 | D. | 生成乙醇的是氢氧化钾的醇溶液? |
14.下列说法正确的是( )
| A. | 常温下,pH均为9的CH3COONa和NaOH溶液中,水的电离程度相同 | |
| B. | 室温下,0.1mol•L-1氨水加水稀释后,溶液中$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| C. | 电解精炼铜过程中,阳极减少的质量与阴极增加的质量一定相等 | |
| D. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则该反应的△H<0 |


 .
. 、
、 .
.