题目内容
17.阿伏加德罗常数的准确值是( )| A. | 12g12C所含有的碳原子数 | B. | 1mol水中电子数 | ||
| C. | 6.02×1023 | D. | 6.02×10-23 |
分析 12g12C中所含有的碳原子数称为阿伏伽德罗常数,据此分析.
解答 解:A、12g12C中所含有的碳原子数称为阿伏伽德罗常数,故阿伏伽德罗常数的准确数值为12g12C中所含有的碳原子数,故A正确;
B、水为10电子微粒,故1mol水中含10mol电子即10NA个,故B错误;
C、12g12C中所含有的碳原子数称为阿伏伽德罗常数,约为6.02×1023个,故6.02×1023不是阿伏伽德罗常数的准确数值,故C错误;
D、12g12C中所含有的碳原子数称为阿伏伽德罗常数,约为6.02×1023个,故D错误.
故选A.
点评 本题考查了基本概念的分析判断,掌握概念内涵,理解概念意义是解题关键,题目较简单.

练习册系列答案
相关题目
7.下列图示实验操作,能达到目的是( )
| A. |  检验K+的存在 | B. |  | C. |  蒸馏 蒸馏 | D. |  检查气密性 |
8.硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发展水平的一种标志.目前的重要生产方法是“接触法”,有关接触氧化反应2SO2+O2$?_{500℃}^{催化剂}$ 2SO3,的说法不正确的是( )
| A. | 该反应为可逆反应,故在一定条件下二氧化硫和氧气不可能全部转化为三氧化硫 | |
| B. | 达到平衡后,反应就停止了,故此时正、逆反应速率相等且均为零 | |
| C. | 一定条件下,向某密闭容器中加入2molSO2和1molO2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 | |
| D. | 在利用上述反应生产三氧化硫时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
5.现有下列三个图象:下列反应中符合下述全部图象的反应是( )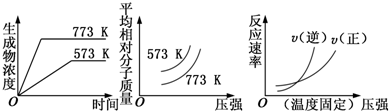

| A. | N2(g)+3H2(g)═2NH3(g)△H<0 | B. | 2SO3(g)?═?2SO2(g)+O2(g)△H>0 | ||
| C. | 4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H<0 | D. | H2(g)+CO(g)?═?C(s)+H2O(g)△H>0 |
12.下列离子方程式中,不正确的是( )
| A. | 向FeBr2溶液中通入少量的Cl2:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| C. | 向Ca(HCO3)2溶液中加入过量的NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
2.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘酒中的碘和酒精 | B. |  验证氨气易溶于水 | ||
| C. |  除去Cl2中的HCl杂质 | D. | 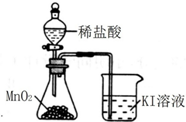 比较MnO2、Cl2、I2 |
6.化学与生产和生活密切相关,下列说法正确的是( )
| A. | 汽油、花生油都是油脂 | |
| B. | 碘元素遇淀粉溶液变蓝色 | |
| C. | 合成纤维、玻璃纤维和光导纤维都是有机高分子化合物 | |
| D. | 铵态氮肥不能与草木灰混合施用 |
7.硝酸与金属反应往往产生氮氧化物,但是在某些特殊情况则不然.将稀硝酸(HNO3浓度低于2mol•L-1)与过量金属镁缓和反应放出气体A,反应完全后向剩余溶液中加入过量NaOH固体并加热,放出气体B,将两次放出气体全部收集并混合,用碱石灰干燥后缓慢通过足量的灼热氧化铜固体,观察到固体变红,将剩余气体用浓硫酸干燥,气体体积变为原来的三分之一,则下列分析不正确的是(本题中所有气体体积均为相同条件下测得的体积)( )
| A. | 灼热氧化铜变红过程发生的反应有2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu | |
| B. | 气体A为H2;气体B为NH3 | |
| C. | 气体A与气体B的体积比为1:2 | |
| D. | 在镁与硝酸反应过程中还原剂与氧化剂的物质的量之比为3:2 |
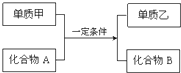 置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
置换反应的通式可用如图表示,单质甲、乙和化合物A、B为中学常见物质,请回答下列问题: