题目内容
为探索工业废料的再利用,某化学兴趣小组设计了如下左图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4?7H2O)和胆矾晶体. 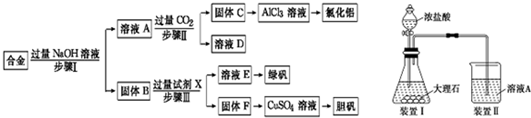
请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是 ,该操作中除用到烧杯和玻璃棒外,还必须用到的玻璃仪器有 .
(2)溶液A中的离子主要有Na+、OH-、 ;试剂X是 .
(3)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是(用离子方程式表示) ;为了避免固体C减少,改进的措施是在装置Ⅰ、Ⅱ之间增加一个盛有饱和 溶液的洗气瓶.
(4)从溶液E中获得绿矾晶体的实验操作依次为(填操作名称) 、冷却结晶、过滤洗涤.

请回答:
(1)步骤Ⅰ、Ⅱ、Ⅲ中均需进行的实验操作是
(2)溶液A中的离子主要有Na+、OH-、
(3)进行步骤Ⅱ时,该小组用如上右图所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是(用离子方程式表示)
(4)从溶液E中获得绿矾晶体的实验操作依次为(填操作名称)
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:金属铁和金属铜不与氢氧化钠反应,铝可与氢氧化钠反应,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4?7H2O)和胆矾晶体流程为:合金与氢氧化钠反应,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所得滤液A为NaAlO2溶液,经途径Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成氢氧化铝固体C,生成的氢氧化铝再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为碳酸氢钠溶液;
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾;铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,即2Cu+O2+2H2SO4=2CuSO4+2H2O,不会产生污染大气的气体,可制得胆矾.
(1)步骤Ⅰ、Ⅱ、Ⅲ都涉及固液分离,固体和液体的分离用过滤法;进行过滤操作时,所用到的玻璃仪器主要有烧杯、漏斗、玻璃棒;
(2)根据步骤Ⅰ加过量的氢氧化钠发生的反应进行解答;
(3)制得的CO2气体中混有氯化氢气体,用饱和的碳酸氢钠除去;
(4)根据固体溶质从溶液中结晶析出的方法是:蒸发溶剂,降温结晶,再过滤分析,硫酸亚铁的溶解度随温度的升高而增大,需采用降温结晶.
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾;铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,即2Cu+O2+2H2SO4=2CuSO4+2H2O,不会产生污染大气的气体,可制得胆矾.
(1)步骤Ⅰ、Ⅱ、Ⅲ都涉及固液分离,固体和液体的分离用过滤法;进行过滤操作时,所用到的玻璃仪器主要有烧杯、漏斗、玻璃棒;
(2)根据步骤Ⅰ加过量的氢氧化钠发生的反应进行解答;
(3)制得的CO2气体中混有氯化氢气体,用饱和的碳酸氢钠除去;
(4)根据固体溶质从溶液中结晶析出的方法是:蒸发溶剂,降温结晶,再过滤分析,硫酸亚铁的溶解度随温度的升高而增大,需采用降温结晶.
解答:
解:金属铁和金属铜不与氢氧化钠反应,铝可与氢氧化钠反应,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4?7H2O)和胆矾晶体流程为:合金与氢氧化钠反应,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,所得滤液A为NaAlO2溶液,经途径Ⅱ与足量二氧化碳发生AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,反应可生成氢氧化铝固体C,生成的氢氧化铝再和盐酸反应生成AlCl3,得到的AlCl3较纯净;溶液D为碳酸氢钠溶液;
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾;铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,即2Cu+O2+2H2SO4=2CuSO4+2H2O,不会产生污染大气的气体,可制得胆矾.
(1)步骤Ⅰ加过量的氢氧化钠,金属铝和氢氧化钠反应,金属铝溶解其中生成偏铝酸钠溶液,金属铁和金属铜不与氢氧化钠反应,将它们分离用过滤;步骤Ⅰ过滤得到的滤液A成分为偏铝酸钠,步骤Ⅱ中向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,溶液中的溶质为碳酸氢钠,将它们分离用过滤;步骤Ⅲ中金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应而金属铜不反应将它们分离用过滤,过滤操作时,所用到的玻璃仪器主要有烧杯、漏斗、玻璃棒,
故答案为:过滤;漏斗;
(2)步骤Ⅰ加过量的氢氧化钠,因铝与碱反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,金属铁和金属铜不与氢氧化钠反应,所以溶液A中的离子主要有AlO2-、Na+、OH-;本实验的目的是用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4?7H2O)和胆矾晶体,金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应生成硫酸亚铁而金属铜不反应,可以实现三种金属的分离,所以试剂X是稀硫酸,
故答案为:AlO2-;稀硫酸;
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的氯化氢气体,氯化氢在水中溶解了部分沉淀氢氧化铝,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去氯化氢的装置,二氧化碳在饱和碳酸氢钠中不溶,氯化氢和碳酸氢钠反应生成二氧化碳气体,所以可在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶,除去二氧化碳中的氯化氢,
故答案为:Al(OH)3+3H+=Al3++3H2O;NaHCO3;
(4)因为硫酸亚铁的溶解度随温度的升高而增大,所以将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,即可得到绿矾,故答案为:蒸发浓缩.
滤渣B为Fe和Cu的化合物,加入足量稀硫酸,得到的滤液E为FeSO4,经蒸发浓缩、冷却结晶可得到绿矾,滤渣F为Cu,可用于制备胆矾;铜不能和稀硫酸反应,但是当加热并通入空气之后,铜和氧气反应生成氧化铜,然后氧化铜会和硫酸反应生成硫酸铜,即2Cu+O2+2H2SO4=2CuSO4+2H2O,不会产生污染大气的气体,可制得胆矾.
(1)步骤Ⅰ加过量的氢氧化钠,金属铝和氢氧化钠反应,金属铝溶解其中生成偏铝酸钠溶液,金属铁和金属铜不与氢氧化钠反应,将它们分离用过滤;步骤Ⅰ过滤得到的滤液A成分为偏铝酸钠,步骤Ⅱ中向偏铝酸钠中通入足量的二氧化碳,会得到纯净的氢氧化铝沉淀,溶液中的溶质为碳酸氢钠,将它们分离用过滤;步骤Ⅲ中金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应而金属铜不反应将它们分离用过滤,过滤操作时,所用到的玻璃仪器主要有烧杯、漏斗、玻璃棒,
故答案为:过滤;漏斗;
(2)步骤Ⅰ加过量的氢氧化钠,因铝与碱反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,金属铁和金属铜不与氢氧化钠反应,所以溶液A中的离子主要有AlO2-、Na+、OH-;本实验的目的是用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4?7H2O)和胆矾晶体,金属铁和金属铜不与氢氧化钠反应,铁和硫酸反应生成硫酸亚铁而金属铜不反应,可以实现三种金属的分离,所以试剂X是稀硫酸,
故答案为:AlO2-;稀硫酸;
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂将制得的CO2气体通入溶液A中.一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是二氧化碳气体中含有从盐酸中挥发出的氯化氢气体,氯化氢在水中溶解了部分沉淀氢氧化铝,发生的反应为Al(OH)3+3H+=Al3++3H2O,为了避免固体C减少,可在制取二氧化碳的收集装置中增加一个洗去氯化氢的装置,二氧化碳在饱和碳酸氢钠中不溶,氯化氢和碳酸氢钠反应生成二氧化碳气体,所以可在装置I和Ⅱ之间增加一个盛有饱和碳酸氢钠溶液的洗气瓶,除去二氧化碳中的氯化氢,
故答案为:Al(OH)3+3H+=Al3++3H2O;NaHCO3;
(4)因为硫酸亚铁的溶解度随温度的升高而增大,所以将混合液来制备绿矾时应先将溶液加热浓缩、然后冷却结晶,即可得到绿矾,故答案为:蒸发浓缩.
点评:本题综合考查物质的制备和性质探究等知识,侧重于学生的分析能力、实验能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,题目难度中等.

练习册系列答案
 寒假学与练系列答案
寒假学与练系列答案
相关题目
下列物质中,不能电离出酸根离子的是( )
| A、Na2SO3 |
| B、Ba(OH)2 |
| C、KMnO4 |
| D、KCl04 |
等质量的下列物质分别与盐酸反应,消耗HCl的物质的量最少的是( )
| A、Na |
| B、Na2O2 |
| C、Na2CO3 |
| D、Ca(HCO3)2 |
如图实验装置,工作过程中乙池CuSO4溶液的浓度没有明显改变,下列有关说法正确的是( )
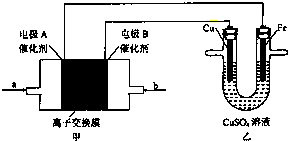

| A、工作是,Cu电极的电极反应为Cu2++2e-=Cu |
| B、工作一段时间后,Cu电极的质量将减小,Fe电极的质量将增加 |
| C、若甲池中a是CH4,b是O2,电解质溶液是KOH,则甲池内溶液的pH将升高 |
| D、若甲池电解质溶液为稀H2SO4,则a为O2,电极A反应为O2+4H++4e-=2H2O |
下列各图所示装置的气密性检查中,漏气的是( )
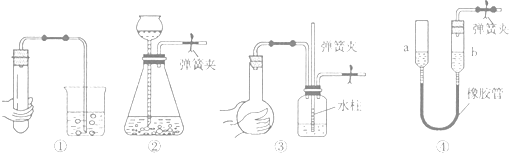

| A、对装置①,双手移去后,导管中水面高于烧杯内水面 |
| B、对装置②,长颈漏斗内液面高度保持不变 |
| C、对装置③,长导管内形成一段水柱 |
| D、对装置④,上下移动a管后,a、b两端液面仍相平 |