题目内容
如图实验装置,工作过程中乙池CuSO4溶液的浓度没有明显改变,下列有关说法正确的是( )
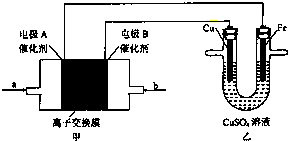

| A、工作是,Cu电极的电极反应为Cu2++2e-=Cu |
| B、工作一段时间后,Cu电极的质量将减小,Fe电极的质量将增加 |
| C、若甲池中a是CH4,b是O2,电解质溶液是KOH,则甲池内溶液的pH将升高 |
| D、若甲池电解质溶液为稀H2SO4,则a为O2,电极A反应为O2+4H++4e-=2H2O |
考点:原电池和电解池的工作原理
专题:
分析:A.甲能自发的进行氧化还原反应而作原电池,乙连接外接电源属于电解池,电镀时,镀层作阳极,镀件作阴极,电解质溶液中含有与镀层金属相同的金属阳离子,铜棒应失去电子;
B.乙为电解池,铜为阳极,发生氧化反应,铁为阴极,发生还原反应;
C.根据甲烷燃料电池反应CH4+2O2+2OH-═CO32-+3H2O知,氢氧根离子参加反应,所以溶液中氢氧根离子浓度降低,溶液的碱性减弱;
D.氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,a为连接铁棒的电极应为原电池的负极;
B.乙为电解池,铜为阳极,发生氧化反应,铁为阴极,发生还原反应;
C.根据甲烷燃料电池反应CH4+2O2+2OH-═CO32-+3H2O知,氢氧根离子参加反应,所以溶液中氢氧根离子浓度降低,溶液的碱性减弱;
D.氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,a为连接铁棒的电极应为原电池的负极;
解答:
解:A.甲能自发的进行氧化还原反应而作原电池,乙连接外接电源属于电解池,工作过程中乙池CuSO4溶液的浓度没有明显改变,乙为电镀池,Cu电极为阳极,电极反应为Cu-2e-=Cu2+,故A错误;
B.工作过程中乙池CuSO4溶液的浓度没有明显改变,为铁上镀铜,根据电镀原理:用Cu在Fe片上镀铜时,镀件铁为阴极,镀层金属铜为阳极,电镀液是含有的镀层金属铜离子的盐,所以铜片作阳极,发生氧化反应,电极方程式为Cu-2e-=Cu2+,d为阴极,发生还原反应,电极方程式为Cu2++2e-=Cu,工作一段时间后,Cu电极的质量将减小,Fe电极的质量将增加,故B正确;
C.甲烷燃料电池中,负极上燃料失电子发生氧化反应,电极反应为CH4-8e-+10OH-═CO32-+7H2O,正极上通入氧化剂,电极反应为2O2+8e-+4H2O═8OH-,反应过程中氢氧根离子参加反应,导致溶液中氢氧根离子浓度减小,故C错误;
D.氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,a为连接铁棒的电极应为原电池的负极,酸性溶液中负极反应为:2H2-4e-=4H+,故D错误;
故选B.
B.工作过程中乙池CuSO4溶液的浓度没有明显改变,为铁上镀铜,根据电镀原理:用Cu在Fe片上镀铜时,镀件铁为阴极,镀层金属铜为阳极,电镀液是含有的镀层金属铜离子的盐,所以铜片作阳极,发生氧化反应,电极方程式为Cu-2e-=Cu2+,d为阴极,发生还原反应,电极方程式为Cu2++2e-=Cu,工作一段时间后,Cu电极的质量将减小,Fe电极的质量将增加,故B正确;
C.甲烷燃料电池中,负极上燃料失电子发生氧化反应,电极反应为CH4-8e-+10OH-═CO32-+7H2O,正极上通入氧化剂,电极反应为2O2+8e-+4H2O═8OH-,反应过程中氢氧根离子参加反应,导致溶液中氢氧根离子浓度减小,故C错误;
D.氢氧燃料电池中通入氢气的一极为原电池的负极,发生氧化反应,通入氧气的一极为原电池的正极,发生还原反应,a为连接铁棒的电极应为原电池的负极,酸性溶液中负极反应为:2H2-4e-=4H+,故D错误;
故选B.
点评:本题综合考查原电池和电解池知识,侧重于学生的分析能力和计算能力的考查,为高考常见题型,注意把握电极方程式的书写,为解答该题的关键,难度中等.

练习册系列答案
相关题目
重金属离子具有毒性.实验室中有甲、乙两种重金属离子的废液,甲废液经化验呈碱性,主要有毒离子为Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低.则乙废液中可能含有的离子是( )
| A、Cu2+和SO42- |
| B、Cu2+和Cl- |
| C、K+和SO42- |
| D、Ag+和NO3- |
当光束通过下列分散系时,能产生丁达尔现象的是( )
| A、Fe(OH)3乳浊液 |
| B、氯化钠溶液 |
| C、盐酸 |
| D、牛奶 |
下列图象的解读和实验操作图示正确的是( )
A、 b中活化能为E1+E2 |
B、 制备乙酸乙酯 |
C、 中和滴定 |
D、 配制溶液 |
某有机化合物3.2g在氧气中完全燃烧,只生成4.4g CO2和3.6g H2O.下列说法正确的是( )
| A、该化合物属于烃 |
| B、该化合物中碳、氢原子个数比为1:2 |
| C、无法确定该化合物是否含有氧元素 |
| D、该化合物中一定含有氧元素 |