题目内容
下表为周期表的一部分,其中的编号代表对应不同的元素.

请回答下列问题.
(1)表中属于d区的元素是 (填编号);元素⑧的原子外围电子排布式是 .
(2)③和⑦形成的常见化合物的晶体类型是 ;②③④的电负性: > > (用元素符号表示).判断依据是 ,气态氢化物最稳定的是 (写化学式);
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中的 (填编号)该元素与元素①形成的化合物X极易溶于水的原因是 .
(4)②③形成一种超硬、耐磨、耐高温的新型无机非金属材料,则其化学式为 ,其熔点比金刚石的 (填“高”或“低”).
(5)⑤的氧化物与⑥的最高价氧化物的水化物反应的方程式 .

请回答下列问题.
(1)表中属于d区的元素是
(2)③和⑦形成的常见化合物的晶体类型是
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,该元素为周期表中的
(4)②③形成一种超硬、耐磨、耐高温的新型无机非金属材料,则其化学式为
(5)⑤的氧化物与⑥的最高价氧化物的水化物反应的方程式
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Al、⑥为S、⑦为Cl、⑧为Cu、⑨为Fe,
(1)d区元素包含周期表中3-10列元素;
(2)依据分子晶体的概念回答;依据电负性大小、气态氢化物的稳定性与非金属性的关系判断;
(3)依据s轨道特点判断n的值,然后回答即可;
(4)依据非金属性以及化合价规律得出化学式,依据键长大小判断熔沸点;
(5)依据化学反应方程式书写方法书写即可.
(1)d区元素包含周期表中3-10列元素;
(2)依据分子晶体的概念回答;依据电负性大小、气态氢化物的稳定性与非金属性的关系判断;
(3)依据s轨道特点判断n的值,然后回答即可;
(4)依据非金属性以及化合价规律得出化学式,依据键长大小判断熔沸点;
(5)依据化学反应方程式书写方法书写即可.
解答:
解:由元素在周期表中位置,可知可知①为H、②为C、③为N、④为O、⑤为Al、⑥为S、⑦为Cl、⑧为Cu、⑨为Fe,
(1)d区元素包含周期表中3-10列元素,上述元素中只有⑨号元素属于d区,元素⑧为Cu,其外围电子排布式是:d104s1,故答案为:⑨;d104s1;
(2)N和Cl形成的常见化合物是NCl3,由分子构成,属于分子晶体,元素的非金属性越强,其电负性越大,气态氢化物越稳定,由于非金属性O>N>C,故电负性:O>N>C,气态氢化物最稳定的是:H2O,故答案为:分子晶体;O>N>C;同周期元素从左到右的非金属性逐渐增强;H2O;
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,s上最多排布2个电子,故n=2,该元素是N,N为周期表中的③,N元素与元素H形成的化合物X为氨气,由于氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键,故答案为:③;氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键;
(4)C、N形成一种超硬、耐磨、耐高温的新型无机非金属材料,N的非金属性强于C,依据化合价规则知C为+4价,N为-3价,故其化学式为:C3N4,其熔点比金刚石的要高,原因是C-N键比C-C键要短,故答案为:C3N4;高;
(5)氧化铝与硫酸反应的方程式是:Al2O3+3H2SO4═Al2(SO4)3+3H2O,故答案为:Al2O3+3H2SO4═Al2(SO4)3+3H2O.
(1)d区元素包含周期表中3-10列元素,上述元素中只有⑨号元素属于d区,元素⑧为Cu,其外围电子排布式是:d104s1,故答案为:⑨;d104s1;
(2)N和Cl形成的常见化合物是NCl3,由分子构成,属于分子晶体,元素的非金属性越强,其电负性越大,气态氢化物越稳定,由于非金属性O>N>C,故电负性:O>N>C,气态氢化物最稳定的是:H2O,故答案为:分子晶体;O>N>C;同周期元素从左到右的非金属性逐渐增强;H2O;
(3)某元素的特征电子排布式(价电子排布式)为nsnnpn+1,s上最多排布2个电子,故n=2,该元素是N,N为周期表中的③,N元素与元素H形成的化合物X为氨气,由于氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键,故答案为:③;氨气和水都是极性分子,氨气和水分子间可以形成分子间氢键;
(4)C、N形成一种超硬、耐磨、耐高温的新型无机非金属材料,N的非金属性强于C,依据化合价规则知C为+4价,N为-3价,故其化学式为:C3N4,其熔点比金刚石的要高,原因是C-N键比C-C键要短,故答案为:C3N4;高;
(5)氧化铝与硫酸反应的方程式是:Al2O3+3H2SO4═Al2(SO4)3+3H2O,故答案为:Al2O3+3H2SO4═Al2(SO4)3+3H2O.
点评:本题考查位置、结构、性质的应用,涉及元素周期表中元素的分区、元素周期表中元素的位置、晶体类型、化学反应等,综合性较强,题目难度较大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
标准状况下,1mol H2O和1molH2相同的是( )
| A、质量 | B、体积 |
| C、原子数 | D、分子数 |
下列说法正确的是( )
| A、原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似 |
| B、Fe3+的最外层电子排布式为3s23p63d5 |
C、基态铜原子的最外层的电子排布图: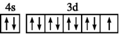 |
| D、所有非金属元素都分布在p区 |
氧化还原反应在生产、生活中具有广泛的用途.下列生产、生活中的事例中没有发生氧化还原反应的是( )
| A、燃放鞭炮 | B、配制生理盐水 |
| C、食物腐烂 | D、湿法炼铜 |
 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是( )| A、⑥、⑧、⑨对应原子的半径依次减小 |
| B、②、⑦的最高价氧化物对应的水化物能相互反应 |
| C、元素⑩为Fe元素,处于常见周期表第四周期第VIIIB族 |
| D、①可分别与③、④、⑤均可形成既含极性键又含非极性键的化合物 |
 将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol?L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断正确的是( )
将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol?L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示.下列有关判断正确的是( )| A、A点所表示的沉淀是:Al(OH)3、BaSO4 |
| B、B-C段所发生反应的离子方程式是:H++OH-→H2O |
| C、A-B段发生反应的离子方程式:Ba2++SO42-→BaSO4↓ |
| D、拐点E的横坐标为70mL |
下列元素一定为主族元素的是( )
| A、其原子最外电子层只1个电子的元素 |
| B、最低负化合价为-3价的元素 |
| C、其原子最外层电子数大于电子层数的元素 |
| D、最高价氧化物对应的水化物是酸的元素 |
