题目内容
常温下,下列溶液中的微粒浓度关系正确的是( )
| A、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(H CO3 -)>c(CO3 2-)>c(H2CO3) |
| C、pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+)>c(OH-)=c(H+) |
| D、0.2 mol?L-1 CH3COOH溶液与0.1 mol?L-1 NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
考点:离子浓度大小的比较
专题:
分析:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
B.NaHCO3溶液的pH=8.3>7,溶液呈碱性,说明HCO3 -的水解程度大于电离程度;
C.pH=11的氨水浓度大于pH=3的HCl溶液,二者等体积混合时氨水有剩余,溶液呈碱性;
D.0.2 mol?L-1 CH3COOH溶液与0.1 mol?L-1 NaOH溶液等体积混合,因为醋酸和NaOH反应,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,CH3COOH电离程度大于CH3COO-水解程度,溶液呈酸性,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
B.NaHCO3溶液的pH=8.3>7,溶液呈碱性,说明HCO3 -的水解程度大于电离程度;
C.pH=11的氨水浓度大于pH=3的HCl溶液,二者等体积混合时氨水有剩余,溶液呈碱性;
D.0.2 mol?L-1 CH3COOH溶液与0.1 mol?L-1 NaOH溶液等体积混合,因为醋酸和NaOH反应,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,CH3COOH电离程度大于CH3COO-水解程度,溶液呈酸性,溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断.
解答:
解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),故A错误;
B.NaHCO3溶液的pH=8.3>7,溶液呈碱性,说明HCO3 -的水解程度大于电离程度,所以c(CO3 2-)<c(H2CO3),故B错误;
C.pH=11的氨水浓度大于pH=3的HCl溶液,二者等体积混合时氨水有剩余,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(Cl-)<c(NH4+),故C错误;
D.0.2 mol?L-1 CH3COOH溶液与0.1 mol?L-1 NaOH溶液等体积混合,因为醋酸和NaOH反应,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,CH3COOH电离程度大于CH3COO-水解程度,溶液呈酸性,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得2c(Na+)=c(CH3COO-)+c(CH3COOH),所以得2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故D正确;
故选D.
B.NaHCO3溶液的pH=8.3>7,溶液呈碱性,说明HCO3 -的水解程度大于电离程度,所以c(CO3 2-)<c(H2CO3),故B错误;
C.pH=11的氨水浓度大于pH=3的HCl溶液,二者等体积混合时氨水有剩余,溶液呈碱性,则c(OH-)>c(H+),根据电荷守恒得c(Cl-)<c(NH4+),故C错误;
D.0.2 mol?L-1 CH3COOH溶液与0.1 mol?L-1 NaOH溶液等体积混合,因为醋酸和NaOH反应,溶液中的溶质为等物质的量浓度的CH3COOH和CH3COONa,CH3COOH电离程度大于CH3COO-水解程度,溶液呈酸性,溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得2c(Na+)=c(CH3COO-)+c(CH3COOH),所以得2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故D正确;
故选D.
点评:本题考查离子浓度大小比较,为高考高频点,正确判断溶液中溶质及其物质的量,再结合溶液酸碱性、原子守恒、电荷守恒分析解答即可,注意:电解质溶液中存在电荷守恒和物料守恒与电解质强弱、溶液浓度无关.

练习册系列答案
相关题目
下列对非金属元素(除稀有气体外)的相关判断正确的是( )
| A、非金属元素都是主族元素,单质在反应中都只能作氧化剂 |
| B、C、N、S三者的单质直接与氧气反应都能至少生成两种氧化物 |
| C、除惰性元素外,周期表中共有16 种非金属元素 |
| D、氧化物常温下都可以与水反应生成酸,所形成的含氧酸盐(MaROb)中的R 元素必定呈现正价 |
化学与生产生活密切相关.下列说法中,正确的是( )
| A、分馏、裂化、裂解是利用化学变化来炼制加工石油的三种重要方法 |
| B、蛋白质、淀粉、纤维素都能在人体内水解并提供能量 |
C、使用聚乙烯塑料制品比使用聚乳酸 (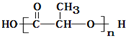 )塑料制品更环保 )塑料制品更环保 |
| D、酶催化反应具有高效、专一、条件温和等特点,化学模拟生物酶对环境保护、节能减排具有重要意义 |
下列事实不能用勒沙特列原理(化学平衡移动原理)解释的是( )
| A、N2+3H2?2NH3△H<0;工业上采用20MPa至50MPa的高压条件 | ||||||||
B、
| ||||||||
C、 | ||||||||
D、
|
沸腾时只需克服范德华力的液体物质是( )
| A、水 | B、酒精 | C、溴 | D、水银 |
下列离子方程式书写正确的是( )
| A、铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ |
| B、FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+ |
| D、AlCl3溶液中加入足量的NaOH溶液:Al3++3OH-═Al(OH)3↓ |

