题目内容
20.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为3Zn+2K2FeO4+8H2O $?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH(1)放电时正极附近溶液的碱性增强(填增强、减小或不变);放电时每转移3mol 电子,有1mol K2FeO4被还原(填氧化或还原)
(2)电池充电时阳极反应为5OH-+Fe(OH)3-3e-=FeO42-+4H2O.
分析 (1)高铁酸钾在正极得到电子,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-;放电时,K2FeO4的化合价由+6价变为+3价,被还原;
(2)充电时,阳极上氢氧化铁转化成高铁酸钾,据此书写阳极电极反应.
解答 解(1)高铁酸钾在正极得到电子,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-;所以正极附近溶液中氢氧根离子浓度增大,则碱性增强;放电时,K2FeO4的化合价由+6价变为+3价,被还原,1molK2FeO4得3mol电子,故当转移3mol电子时,有1molK2FeO4被还原.
故答案为:增强;1;还原;
(2)充电时,阳极上氢氧化铁转化成高铁酸钾,电极反应式为5OH-+Fe(OH)3-3e-=FeO42-+4H2O,故答案为:5OH-+Fe(OH)3-3e-=FeO42-+4H2O.
点评 本题考查了学生运用原电池、电解等基础理论解决新情景问题的能力,本题难度不大,注意掌握电极反应式的书写及电子转移数目的判断.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
10.已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变棕黄色.下列判断正确的是( )
| A. | 实验②证明Fe2+既有氧化性又有还原性 | |
| B. | 上述实验中,有一个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 上述实验证明氧化性:MnO4->Cl2>Fe3+ |
11.线型弹性材料“丁苯吡橡胶”的结构简式如下: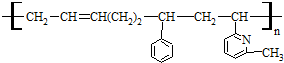
其单体可能是:
①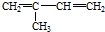
②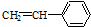
③CH2-CH-CH═CH
④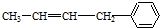
⑤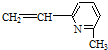
⑥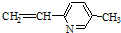
正确的组合是( )

其单体可能是:
①
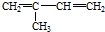
②
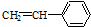
③CH2-CH-CH═CH
④
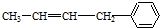
⑤

⑥
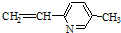
正确的组合是( )
| A. | ②③⑥ | B. | ①②⑥ | C. | ②③⑤ | D. | ②④⑥ |
8.短周期主族元素X、Y、Z、W原子序数依次增大,X与Z原子序数相差8,Y元素的焰色为黄色,Z元素的最高价为+6.下列叙述正确的是 ( )
| A. | 半径:r(X2-)>r(Y+) | B. | 沸点:H2Z>H2X | C. | 稳定性:H2Z>HW | D. | 熔点:Y2X>Y2Z |
5.下列有关钢铁腐蚀和防护的说法不正确的是( )
| A. | 钢铁发生析氢腐蚀的正极反应:2H++2e-═H2↑ | |
| B. | 钢铁发生吸氧腐蚀的负极反应:Fe-3e-═Fe3+ | |
| C. | 自行车的钢圈上镀一层铬,防止生锈 | |
| D. | 外加直流电源保护钢闸门时,钢闸门与直流电源的负极相连 |
12.天津港“8.12”瑞海公司危险品仓库特大火灾爆炸事故,其二次爆炸威力巨大.据推测可能是由于某物质遇水燃烧而引发的连锁反应.下列常见危险品中最有可能具有这种性质的是( )
| A. | KN03 | B. | NH4NO3 | C. | CaC2 | D. | P4(白磷) |
9.用图所示装置进行相应的实验,能达到实验目的或得出相应结论的是( )
| ① | ② | ③ | 实验结论或目的 | 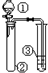 | |
| A | 浓盐酸 | KMnO4 | 石蕊试液 | 氯气的水溶液有酸性、漂白性 | |
| B | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| C | 硝酸 | Na2CO3溶液 | Na2SiO3溶液 | 比较硝酸、碳酸、硅酸酸性强弱 | |
| D | 溴水 | FeBr3、苯 | AgNO3溶液 | 苯和溴水能发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
10.将钠投人到FeC12溶液,整个变化过程中( )
| A. | 有单质铁生成 | B. | 有气泡产生、最终有白色沉淀生成 | ||
| C. | 氧化剂只有H20 | D. | 被氧化的元素有钠、铁两种元素. |
 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.