题目内容
15. 用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制).
用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制).已知:①NO+NO2+2OH-→2NO2-+H2O
②气体液化温度:NO2 21℃,NO-152℃
试回答:
(1)写出装置A中发生反应的化学方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.
(2)选择所需的仪器的连接顺序(按左→右连接,填各接口的编号)为1-5-4-10-11-6-7-3(或1-5-4-11-10-6-7-3).在填加药品前应先进行的操作是检验装置的气密性.
(3)反应前先通入N2,目的是排尽空气,防止NO被氧化;
(4)确认气体中含NO的现象是通入O2后有红棕色生成.
(5)装置B、F的作用是吸收尾气;分离NO、NO2.
(6)若从A出来的混合气体中NO2、NO的体积转化为标准状况下分别为V1mL、V2mL(V1<V2),且最终氮的氧化物完全被溶液吸收,装置中至少需要充入氧气的体积为:1.4V2(相同状态下).
分析 (1)装置A中铜与浓硝酸反应生成硝酸铜、二氧化氮和水;硝酸变淡,Cu与稀硝酸反应生成硝酸铜、NO和水;
(2)根据实验的目的和各部分的作用确定连接顺序,洗气需长管进短管出,排气需根据密度大小选择导管的进出端,在装入药品前应先检验装置的气密性;
(3)NO易被氧化成二氧化氮;
(4)二氧化氮为红棕色气体,NO易被氧化成二氧化氮,气体中含NO,通入O2后有红棕色生成;
(5)装置B吸收尾气,根据气体液化温度分析F的作用;
(6)根据4NO+3O2+2H2O=4HNO3分析.
解答 解:(1)装置A中铜与浓硝酸反应,铜被氧化成硝酸铜,硝酸被还原成二氧化氮,反应的化学反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,硝酸变淡,Cu与稀硝酸反应生成硝酸铜、NO和水,反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(2)A中铜与浓硝酸反应NO2进入C浓硫酸干燥,洗气需长管进短管出,仪器连接顺序为:1-5,NO2 21℃,NO-152℃,然后进入F冰水混合物冷却使二氧化氮液化分离,剩余的NO进入D与氧气反应,最后连接尾气处理装置,所以仪器连接顺序为:1-5-4-10-11-6-7-3(或1-5-4-11-10-6-7-3);凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,所以该实验在装入药品前应先检验装置的气密性,
故答案为:1-5-4-10-11-6-7-3(或1-5-4-11-10-6-7-3);检验装置的气密性;
(3)因NO易被氧化,若装置中存在氧气则不能说明NO的存在,所以反应前先通入N2目的是排尽装置中的空气,防止NO被氧化,
故答案为:排尽空气,防止NO被氧化;
(4)因NO与氧气反应生成二氧化氮,则确认气体中含NO的现象是观察到D中烧瓶内通入O2后,无色气体变成红棕色,
故答案为:通入O2后有红棕色生成;
(5)装置B中盛放氢氧化钠,吸收尾气,反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O,已知气体液化温度:NO2:21℃,NO:-152℃,所以装置F通过冰水混合物的冷却二氧化氮变为液体,一氧化氮仍为气体,使二者分离,
故答案为:吸收尾气;分离NO、NO2;
(6)NO2吸收无需氧气,一氧化氮吸收的反应为:4NO+3O2+2H2O=4HNO3,所以V2mLNO至少需要充入氧气的体积为:0.75V2,
故答案为:0.75V2.
点评 本题以硝酸的性质为载体,考查学生实验对实验原理、实验装置的理解以实验方案设计,关键是理解实验原理以及掌握氮及其化合物的性质,题目难度中等.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案| A. | 18O、31P、119Sn | B. | 27Al、19F、12C | ||
| C. | 7N、15P、33As、51Sb、83Bi | D. | 只有一个电子层的原子 |
| A. | 脱水性 | B. | 吸水性 | C. | 酸性 | D. | 不挥发性 |

| A. | M的化学性质活泼 | B. | L中的化学键是极性键 | ||
| C. | E能使紫色的石蕊试液变蓝 | D. | G是最活泼的非金属单质 |
| A. | 11克 | B. | 22克 | C. | 44克 | D. | 5.6克 |
| 选项 | 甲 | 乙 |
| A | 电解质 | BaSO4、NaHSO4、SO3 |
| B | 弱电解质的电离 | 均分步电离 |
| C | 化学平衡影响因素 | 温度、压强、浓度、催化剂等 |
| D | 化学电源 | 一次电池、二次电池、燃料电池等 |
| A. | A | B. | B | C. | C | D. | D |
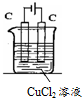 电解氯化铜溶液的化学方程式为CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑.电解过程中,Cu2+离子向阴极移动;Cl-在阳极失电子,发生氧化反应(填“氧化”或“还原”).电解过程中,如果有0.4mol的电子发生转移,理论上阴极的质量将增加12.8g.
电解氯化铜溶液的化学方程式为CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu+Cl2↑.电解过程中,Cu2+离子向阴极移动;Cl-在阳极失电子,发生氧化反应(填“氧化”或“还原”).电解过程中,如果有0.4mol的电子发生转移,理论上阴极的质量将增加12.8g.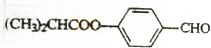 E的合成路线如下:
E的合成路线如下: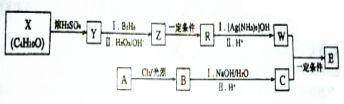
 .X→Y的反应类型是消去反应.
.X→Y的反应类型是消去反应.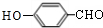 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$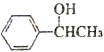 )为原料合成苯乙醛,设计合成路线:
)为原料合成苯乙醛,设计合成路线: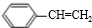 $\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$
$\frac{Ⅰ.{B}_{2}{H}_{6}}{Ⅱ.{H}_{2}{O}_{2}/OH}$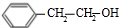 $\stackrel{Cu/△}{→}$
$\stackrel{Cu/△}{→}$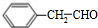 .
.