题目内容
4.(1)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);(2)pH相等时,①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中c(NH4+)由大到小的顺序为①=②>③;
(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则盐酸的体积<氨水的体积(填“>”“=”或“<”);
(4)等体积的NH4HSO4溶液与NaOH溶液混合呈中性,则原C(NH4HSO4)<原C(NaOH) (填“>”“=”或“<”),混合后溶液中C(SO42-)>C(NH4+) (填“>”“=”或“<”).
分析 (1)加热后氢氧化钠溶液的pH基本不变,而醋酸钠的水解程度增大,溶液pH增大;
(2)氢离子抑制铵根离子水解,电离出铵根离子浓度越多的其物质的量浓度越小,据此判断;
(3)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),根据电荷守恒判断溶液酸碱性,氯化铵溶液呈酸性,要使混合溶液呈中性,则氨水应该稍微过量;
(4)当二者的浓度相等时,反应生成硫酸铵,溶液显示酸性,则氢氧化钠浓度应该稍大些,才能满足溶液为中性;根据混合液中的物料守恒判断硫酸根离子和铵根离子浓度大小.
解答 解:(1)pH相等的NaOH溶液与CH3COONa溶液,醋酸钠为强碱弱酸盐,醋酸根离子水解溶液显示碱性,加热后醋酸根离子的水解程度增大,则溶液pH增大,所以分别加热到相同的温度后CH3COONa溶液的pH>NaOH溶液的pH,
故答案为:>;
(2)①NH4Cl是强酸弱碱盐,铵根离子能水解但较弱,②(NH4)2SO4是强酸弱碱盐,铵根离子能水解但较弱,③电离出氢离子抑制铵根离子水解;所以当它们pH相同时,c(NH4+)大小顺序为①=②>③,
故答案为:①=②>③;
(3)氯化铵溶液呈酸性,要使混合溶液呈中性,则氨水应该稍微过量,所以盐酸的体积<氨水的体积,
故答案为:<;
(4)等体积的NH4HSO4溶液与NaOH溶液混合呈中性,若二者的浓度相等时,反应生成硫酸铵,铵根离子部分水解,溶液为酸性,若为中性,则氢氧化钠浓度应该稍大些,即:c(NH4HSO4)<c(NaOH);根据物料守恒可知:c(SO42-)=c(NH4+)+c(NH3•H2O),则c(SO42-)>c(NH4+),
故答案为:<;>.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、酸碱混合的定性判断、离子浓度大小判断等知识,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力.

| A. | 卫星上的太阳能电池工作 | |
| B. | 向氢氧化铁胶体中加入稀硫酸产生红褐色沉淀 | |
| C. | 向鸡蛋清中加入饱和硫酸铵溶液,产生白色沉淀 | |
| D. | 向盛有红墨水的试管中加入活性炭,振荡,红色褪去 |
| A. | 2-甲基丙烷的所有碳原子可能处于同一平面 | |
| B. | 一定条件下,Cl2可在甲苯(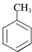 )的苯环或侧链上发生取代反应 )的苯环或侧链上发生取代反应 | |
| C. | 乙烷和丙烯(C3H6)的物质的量各1mol,完全燃烧都是生成3mol H2O | |
| D. | 光照下2,2-二甲基丙烷与Cl2反应其一氯代物只有一种 |
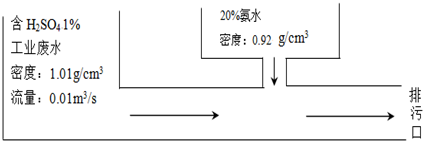
| A. | 1.98×10-3m3/s | B. | 5.49×10-4m3/s | C. | 1.90×10-4 m3/s | D. | 9.52×10-5 m3/s |
| A. | 酚酞呈无色的溶液中:K+、Al3+、Cl-、HCO3- | |
| B. | 使pH试纸变深蓝色的溶液中:ClO-、Na+、AlO2-、SO42- | |
| C. | 甲基橙呈红色的溶液中:NH4+、I-、Fe2+、SO42- | |
| D. | 加入铝粉产生氢气的溶液:Na+、SO42-、Mg2+、NO3- |
 用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制).
用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器可选择使用,N2和O2的用量可自由控制). 对于如图所示的有机化合物的说法,正确的有①②③④⑦.
对于如图所示的有机化合物的说法,正确的有①②③④⑦.