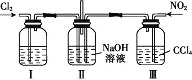
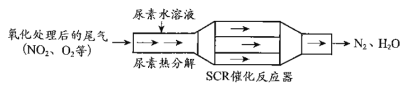
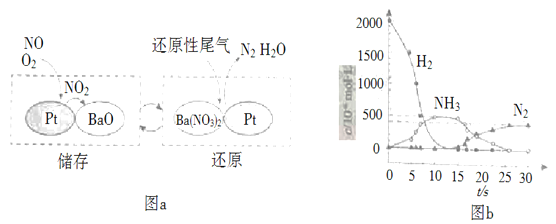
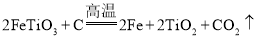题目内容
【题目】(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6 kJ的热量,试写出对应的热化学方程式___________________。标准状况下11.2L氢气在氯气中充分燃烧放出的热量是______kJ。
(2)A(g)+B(g)![]() C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量(kJ)变化如图所示,回答下列问题。
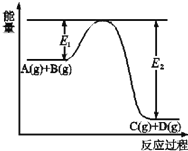
①反应物A(g)和B(g)具有的总能量_______(填大于、小于、等于)生成物C(g)和D(g)具有的总能量。
②该反应是_______反应(填吸热、放热),△H=_____(用E1和E2表示)。
【答案】H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJmol-1 92.3 大于 放热 E1-E2
【解析】
(1)1mol氢气在氯气中充分燃烧生成氯化氢气体时放出184.6 kJ的热量,因此对应的热化学方程式为H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJmol-1,标准状况下11.2L氢气的物质的量为0.5mol,在氯气中充分燃烧放出的热量是0.5mol×184.6 kJmol-1=92.3 kJ。
(2)①由图像可知,该反应是放热反应,反应物A(g)和B(g)具有的总能量大于生成物C(g)和D(g)具有的总能量;
②该反应是放热反应,反应热△H=E1-E2。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目