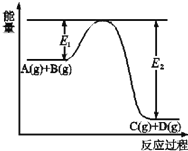
题目内容
【题目】在一恒容的密闭容器中充入0.1 mol·L-1 CO2、0.1 mol·L-1CH4,在一定条件下发生反应:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图。下列有关说法不正确的是( )
2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图。下列有关说法不正确的是( )
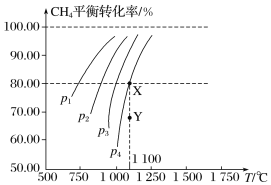
A.压强为p4时,在Y点:v正<v逆B.上述反应的ΔH>0
C.压强:p4>p3>p2>p1D.1 100 ℃时该反应平衡常数约为1.64
【答案】A
【解析】
A. 压强为p4时,在Y点,反应将向X点移动,即向CH4的转化率增大的方向(即正反应方向)移动,所以v正>v逆,A不正确;
B. 由图中曲线可以看出,温度升高,CH4的转化率增大,即平衡向正反应方向移动,所以正反应的ΔH>0,B正确;
C. 从p1到p4,CH4的转化率减小,即平衡逆向移动,应为增大压强,所以p4>p3>p2>p1,C正确;
D. 1 100 ℃时,三段式关系如下:

该反应平衡常数K=![]() =1.64,D正确。
=1.64,D正确。
故选A。

【题目】请回答下列问题。
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度。

①100℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)=______mol·L-1,Kw(25℃)________Kw(100℃) (填“>”、“<”或“=”)。
②25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是_____(填“促进”、“抑制”或“不影响”)。
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
化学式 | 电离平衡常数(25℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25℃时,有等浓度的a.NaCN溶液b.CH3COONa 溶液c.Na2CO3溶液,三种溶液的pH由大到小的顺序为_____________________;(填序号)
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,则c(Na+)__________c(CH3COO-)(填“>”、“<”或“=”);
(3)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-4 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为__________________。
【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:![]()
![]()
![]() 。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)写出该反应的平衡常数表达式_______________。
(2)前2s内的平均反应速率![]() __________;达到平衡时,CO的转化率为__________。
__________;达到平衡时,CO的转化率为__________。
【题目】2019年诺贝尔化学奖授予约翰·古迪纳夫、斯坦利·威廷汉和吉野彰,表彰他们对锂离子电池研究的贡献。磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片(除LiFePO4外,还含有Al箔、少量不溶于酸碱的导电剂)中的资源,部分流程如图:
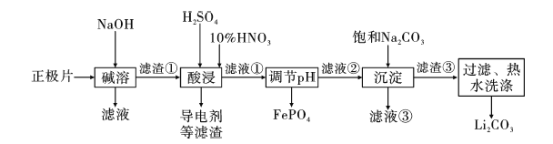
已知:KSP ( Li2CO3)=2.0×10-3 。部分物质的溶解度(S)如下表所示:
T℃ | S(Li2CO3)/g | S(Li2SO4)/g | S(Li3PO4)/g |
20 | 1.33 | 34.2 | 0.039 |
80 | 0.85 | 30.5 | —— |
100 | 0.72 | —— |
(1) 流程中用“热水洗涤”的原因是____________。
(2)写出碱溶时Al箔溶解的化学方程式 ___________。
(3)酸浸时,用H2O2代替HNO3更好,其优点是________。
(4)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为____。
(5)若滤液②中c(Li+)=4mol/L,加入等体积的Na2CO3溶液后,Li+的沉降率达到90%,计算滤液③中c(CO32-)=____mol/L