题目内容
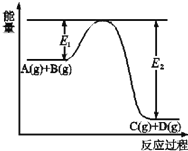
【题目】根据碘与氢气反应的热化学方程式
(i)I2(g)+H2(g)![]() 2HI(g)ΔH=-9.48kJ·mol-1
2HI(g)ΔH=-9.48kJ·mol-1
(ii)I2(s)+H2(g)![]() 2HI(g)ΔH=+26.48kJ·mol-1
2HI(g)ΔH=+26.48kJ·mol-1
下列判断正确的是( )
A.254gI2(g)中通入2gH2(g),反应放热9.48kJ
B.1mol固态碘与1mol气态碘所含的能量相差17.00kJ
C.反应(Ⅰ)的产物比反应(Ⅱ)的产物稳定
D.反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低
【答案】D
【解析】
A. 254gI2(g)和2gH2(g)各为1mol,反应为可逆反应,不能进行完全,放热小于9.48 kJ,故A错误;
B. 由盖斯定律(Ⅰ)﹣(Ⅱ)得I2(g)=I2(s) ΔH=+35.96 kJ·![]() ,故1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ, B错误;
,故1 mol固态碘与1 mol气态碘所含的能量相差35.96 kJ, B错误;
C. 反应(Ⅰ)、反应(Ⅱ)的产物都是HI(g),状态相同,稳定性一样,故C错误;
D. 对于同一物质,固态物质的能量比气态物质能量低,故反应(Ⅱ)的反应物总能量比反应(Ⅰ)的反应物总能量低,故D正确;
答案选D。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:![]()
![]()
![]() 。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)写出该反应的平衡常数表达式_______________。
(2)前2s内的平均反应速率![]() __________;达到平衡时,CO的转化率为__________。
__________;达到平衡时,CO的转化率为__________。