题目内容
实验室需配制500mL 0.2mol/LNa2SO4溶液
(1)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、玻璃棒,还缺少的必要仪器是
(2)在天平上称取 g的硫酸钠固体
(3)下列情况中,会使所配溶液浓度偏高的是 (填序号).
A、某同学观察液面时俯视 B、没有洗涤玻璃棒和烧杯
C、加蒸馏水时,不慎超过了刻度线 D、容量瓶使用前内壁沾有水珠.
(1)本实验用到的基本仪器已有烧杯、天平(砝码、镊子)、玻璃棒,还缺少的必要仪器是
(2)在天平上称取
(3)下列情况中,会使所配溶液浓度偏高的是
A、某同学观察液面时俯视 B、没有洗涤玻璃棒和烧杯
C、加蒸馏水时,不慎超过了刻度线 D、容量瓶使用前内壁沾有水珠.
考点:配制一定物质的量浓度的溶液
专题:实验题
分析:(1)根据配制一定物质的量浓度的溶液中使用的仪器判断还缺少的仪器;
(2)根据500mL 0.2mol/LNa2SO4溶液中含有的溶质硫酸钠的物质的量计算出需要硫酸钠的质量;
(3)根据c=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
(2)根据500mL 0.2mol/LNa2SO4溶液中含有的溶质硫酸钠的物质的量计算出需要硫酸钠的质量;
(3)根据c=
| n |
| V |
解答:
解:(1)配制500mL 0.2mol/LNa2SO4溶液需要使用的仪器有:托盘天平、药匙、烧杯、量筒、500mL容量瓶、胶头滴管,还缺少的仪器为:500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶、胶头滴管;
(2)500mL 0.2mol/LNa2SO4溶液中含有溶质硫酸钠0.1mol,需要硫酸钠的质量为:m=142g/mol×0.1mol=14.2g,
故答案为:14.2;
(3)A、某同学观察液面时俯视,导致加入的蒸馏水体积偏小,根据c=
可得,配制的溶液浓度偏高,故A正确;
B、没有洗涤玻璃棒和烧杯,导致配制的溶液中溶质的物质的量偏小,根据c=
可得,配制的溶液浓度偏低,故B错误;
C、加蒸馏水时,不慎超过了刻度线,导致配制的溶液体积偏大,根据c=
可得,配制的溶液浓度偏低,故C错误;
D、容量瓶使用前内壁沾有水珠,对溶液体积及溶质的物质的量都没有影响,根据c=
可得,配制结果无影响,故D错误;
故选A.
故答案为:500mL容量瓶、胶头滴管;
(2)500mL 0.2mol/LNa2SO4溶液中含有溶质硫酸钠0.1mol,需要硫酸钠的质量为:m=142g/mol×0.1mol=14.2g,
故答案为:14.2;
(3)A、某同学观察液面时俯视,导致加入的蒸馏水体积偏小,根据c=
| n |
| V |
B、没有洗涤玻璃棒和烧杯,导致配制的溶液中溶质的物质的量偏小,根据c=
| n |
| V |
C、加蒸馏水时,不慎超过了刻度线,导致配制的溶液体积偏大,根据c=
| n |
| V |
D、容量瓶使用前内壁沾有水珠,对溶液体积及溶质的物质的量都没有影响,根据c=
| n |
| V |
故选A.
点评:本题考查了配制一定物质的量浓度的溶液的方法,题目难度中等,注意掌握配制一定物质的量浓度的溶液方法,试题基础性强,贴近高考,难易适中,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法.

练习册系列答案
相关题目
Na、Mg、Al各0.1mol 投入100mL0.2molL/L的硫酸溶液,相同条件下产生的气体体积比为( )
| A、1:1:1 |
| B、5:2:2 |
| C、1:2:3 |
| D、6:3:2 |
已知温度T时水的离子积常数为Kw.该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
| A、a=b | ||
| B、混合溶液的pH=7 | ||
C、混合溶液中,c(H+)=
| ||
| D、向反应后的混合液中滴加石蕊试液后呈紫色 |
下列四种离子混合时不会发生反应的是( )
| A、OH-、Ca2+、CO32-、Cu2+ |
| B、Na+、Cl-、Mg2+、Fe3+ |
| C、H+、HCO3-、Al3+、CO32- |
| D、Ba2+、OH-、SO42-、NH4+ |
一定条件下进行反应:COCl2(g)?Cl2(g)+CO(g),向2.0L恒容密闭容器中充入1.0mol COCl2(g),经过一段时间后达到平衡.反应过程中测得的有关数据见下表:
下列说法正确的是( )
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
| A、保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol?L-1,则反应的△H<0 |
| B、若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变 |
| C、保持其他条件不变,起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,反应达到平衡前的速率:v(正)<v(逆) |
| D、保持其他条件不变,起始向容器中充入1.0 molCl2和0.8 molCO,达到平衡时,Cl2的转化率小于60% |

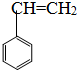 ;②CH3-CH=CH-CH3; ③CH2=CH-CH=CH2;④CH≡C-CH3;⑤
;②CH3-CH=CH-CH3; ③CH2=CH-CH=CH2;④CH≡C-CH3;⑤