题目内容
11.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )①NaOH固体
②H2O
③CuSO4固体
④CH3COONa固体
⑤NaNO3固体
⑥NaCl溶液.
| A. | ②④⑥ | B. | ①② | C. | ②③⑤ | D. | ②④⑤⑥ |
分析 Fe过量,为了减缓反应速率,且不影响生成氢气的总量,可减小氢离子的浓度,但不能改变氢离子的物质的量,以此来解答.
解答 解:①加入NaOH固体,消耗盐酸,生成氢气的总量减小,故错误;
②加入H2O,体积增大,浓度减小,物质的量不变,则减缓反应速率,且不影响生成氢气的总量,故正确;
③加入CuSO4固体,形成原电池反应,反应速率增大,故错误
④加入CH3COONa固体,与盐酸反应生成醋酸,氢离子浓度减小,物质的量不变,则减缓反应速率,且不影响生成氢气的总量,故正确;
⑤加入NaNO3固体,在酸性条件下硝酸根离子具有强氧化性,与铁反应生成NO,故错误;
⑥加入NaCl溶液,溶液体积增大,浓度减小,但物质的量不变,则减缓反应速率,且不影响生成氢气的总量,故正确.
故选A.
点评 本题考查影响反应速率的因素,为高考常考考点,注意Fe过量,生成氢气由盐酸决定,把握浓度对反应速率的影响即可解答,题目难度不大

练习册系列答案
相关题目
10. 一定温度下向体积为2L的恒容密闭容器中充入6molCO2和8mo1H2,发生反应:CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49KJ•mol-1.测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )
一定温度下向体积为2L的恒容密闭容器中充入6molCO2和8mo1H2,发生反应:CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49KJ•mol-1.测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )
 一定温度下向体积为2L的恒容密闭容器中充入6molCO2和8mo1H2,发生反应:CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49KJ•mol-1.测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )
一定温度下向体积为2L的恒容密闭容器中充入6molCO2和8mo1H2,发生反应:CO2 (g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49KJ•mol-1.测得n(H2)物质的量随时间变化如曲线I 所示,下列说法正确的是( )| A. | 该反应在O~8min内的v(CO2)=0.125mol•L-1•min-1 | |
| B. | 若起始时向容器中充入3mo1CO2和4molH2,则平衡时CH3OH的体积分数大于20% | |
| C. | 若起始时向容器中充入4mo1CO2和2molH2、2molCH3OH、1molH2O(g),则此时反应v(正)>v(逆) | |
| D. | 曲线II、曲线III改变条件分别是升高温度、减小压强 |
6.某物质经分析只含有一种元素,则该物质不可能是( )
| A. | 单质 | B. | 化合物 | C. | 混合物 | D. | 纯净物 |
16.下列叙述错误的是( )
| A. | 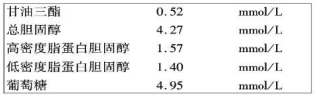 如图是一张体检血液化验单,化验单表示该体检指标的物理量是物质的量 | |
| B. | 水和四氯化碳可以用分液漏斗分离 | |
| C. | 烧杯、试管、蒸发皿、圆底烧瓶、蒸馏烧瓶都可用酒精灯加热 | |
| D. | 98%的浓硫酸,密度为 1.84g/mL,其物质的量浓度为 18.4mol/L |
3.已知:Fe+Cu2+═Fe2++Cu和2Fe3++Cu═2Fe2++Cu2+,则下列判断不正确的是( )
| A. | Fe3+、Cu2+、Fe2+氧化性依次减弱 | |
| B. | 可发生反应:Fe+2Fe3+═3Fe2+ | |
| C. | Fe、Fe2+、Cu还原性依次减弱 | |
| D. | 将铁、铜混合粉末放入FeCl3溶液中,铁粉先溶解 |
20.下列属于加成反应的是( )
| A. | 乙烯通入溴水中使溴水褪色 | |
| B. | 乙烯使酸性高锰酸钾溶液褪色 | |
| C. | 四氯化碳与溴水混合振荡,静置后溴水褪色 | |
| D. | 乙烷与Cl2光照条件下反应 |
8.下列能达到实验目的是( )
| A. | 在量筒中加入一体积的水,再加入浓硫酸配制稀硫酸 | |
| B. | 用澄清石灰水检验CO中含有的CO2 | |
| C. | 用玻璃棒搅拌漏斗中的液体以加快过滤速度 | |
| D. | 加入盐酸以除去硫酸钠中的少许碳酸钠杂质 |
 聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注.PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA.已知①工业上用乙烯和氯气为原料合成PVC.②次氯酸能跟乙烯发生加成反应:
聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注.PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA.已知①工业上用乙烯和氯气为原料合成PVC.②次氯酸能跟乙烯发生加成反应: