题目内容
 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A、阳离子交换膜可阻止Br2与Zn直接发生反应 |
| B、放电时负极的电极反应式为Zn-2e-=Zn2+ |
| C、充电时电极a连接电源的负极 |
| D、放电时左侧电解质储罐中的离子总浓度增大 |
考点:化学电源新型电池
专题:电化学专题
分析:A、阳离子交换膜只允许阳离子通过,还起到隔膜的作用;
B、原电池的两极反应中,负极上发生失电子的氧化反应;
C、充电时,电池的正极和电源的正极相接;
D、根据电池的两极反应来确定离子浓度的变化;
B、原电池的两极反应中,负极上发生失电子的氧化反应;
C、充电时,电池的正极和电源的正极相接;
D、根据电池的两极反应来确定离子浓度的变化;
解答:
解:根据图示的信息,结合原电池等工作原理,原电池的负极是金属锌失电子的过程,所以b是负极,a是正极.
A、阳离子交换膜只允许阳离子通过,还起到隔膜的作用,可阻止Br2与Zn直接发生反应,故A正确;
B、原电池的两极反应中,负极上发生失电子的氧化反应,即Zn-2e-=Zn2+,故B正确;
C、充电时,电池的正极和电源的正极相接,即电极a连接电源的正极,故C错误;
D、放电时,右侧生成的锌离子移向左侧,左侧溴单质发生得电子的还原反应生成溴离子,所以左侧电解质储罐中的离子总浓度增大,故D正确;
故选C.
A、阳离子交换膜只允许阳离子通过,还起到隔膜的作用,可阻止Br2与Zn直接发生反应,故A正确;
B、原电池的两极反应中,负极上发生失电子的氧化反应,即Zn-2e-=Zn2+,故B正确;
C、充电时,电池的正极和电源的正极相接,即电极a连接电源的正极,故C错误;
D、放电时,右侧生成的锌离子移向左侧,左侧溴单质发生得电子的还原反应生成溴离子,所以左侧电解质储罐中的离子总浓度增大,故D正确;
故选C.
点评:本题考查原电池的工作原理,题目难度不大,注意把握原电池中电子及溶液中离子的定向移动问题,本题从化合价的变化进行判断是做题的关键.

练习册系列答案
相关题目
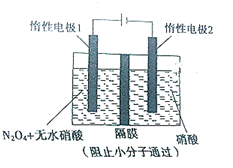 用如图装置电解制备N2O5 ,下列有关说法正确的是( )
用如图装置电解制备N2O5 ,下列有关说法正确的是( )| A、N2O5在惰性电极2处产生 |
| B、在惰性电极2处有氢气产生 |
| C、在惰性电极1处发生还原反应 |
| D、在惰性电极2处有NO产生 |
单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高.下列溶液中沸点最高的是( )
| A、0.01 mol/L的蔗糖溶液 |
| B、0.01 mol/L的K2SO4溶液 |
| C、0.02 mol/L的NaCl溶液 |
| D、0.02 mol/L的CH3COOH溶液 |
下列各组离子,能在溶液中大量共存的是( )
| A、Na+、Cu2+、Cl-、SO42- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、H+、Cl-、CO32- |
| D、K+、H+、SO42-、OH- |
下列溶液中各微粒的浓度关系不正确的是( )
| A、0.1 mol?L-1的HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+) | ||||||||||
B、等浓度、等体积的Na2CO3和NaHCO3混合:
| ||||||||||
| C、0.1 mol?L-1 的NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | ||||||||||
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) |
已知氧化还原反应:KClO3+6HCl═3Cl2↑+KCl+3H2O,下列说法正确的是( )
| A、Cl2是氧化产物,KCl是还原产物 |
| B、盐酸在该反应中只表现还原性 |
| C、每生成3 mol Cl2,有1 mol KClO3发生氧化反应 |
| D、每转移0.1 mol电子,能生成标准状况1344mLCl2 |
当光束通过下列分散系时,可观察到丁达尔效应的是( )
| A、NaCl溶液 |
| B、H2SO4溶液 |
| C、CuSO4溶液 |
| D、Fe(OH)3胶体 |
下列装置用于实验室中制取干燥氨气的实验,能达实验目的是( )

| A、用装置甲制备氨气 |
| B、用装置乙除去氨气中少量水 |
| C、用装置丙收集氨气 |
| D、用装置丁吸收多余的氨气 |