题目内容
 某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:A.用蒸馏水洗涤滴定管和锥形瓶
B.用待测定的溶液润洗酸式滴定管、用标准的NaOH溶液润洗碱式滴定管.
C.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作一次
E.检查滴定管是否漏水
F.将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)
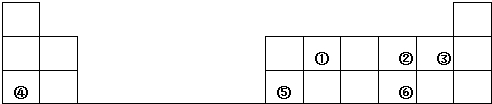
(2)操作F中应该选择如图中
(3)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化;B.锥形瓶内溶液颜色的变化;
滴定终点溶液颜色的变化是
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 1 | 20 | 1.02 | 21.04 | |
| 2 | 20 | 2.00 | 25.00 | |
| 3 | 20 | 0.60 | 20.58 | |
(5)如果准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?
考点:中和滴定
专题:实验题
分析:(1)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;
(2)用碱式滴定管盛装KOH溶液;
(3)实验中应控制流速并观察锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)先判断数据的有效性,然后求出平均值,最后根据关系式HCl~NaOH来计算出盐酸的浓度;
(5)根据关系式HCl~NaOH来计算出盐酸的浓度.
(2)用碱式滴定管盛装KOH溶液;
(3)实验中应控制流速并观察锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)先判断数据的有效性,然后求出平均值,最后根据关系式HCl~NaOH来计算出盐酸的浓度;
(5)根据关系式HCl~NaOH来计算出盐酸的浓度.
解答:
解:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为:EABFCG,故答案为:E;A;F;G;
(2)滴定管乙下端是橡皮管,为碱式滴定管,故答案为:乙;
(3)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中颜色变化,无色变浅红色且半分钟内不褪色,可说明达到滴定终点;故答案为:B;无色变浅红色且半分钟内不褪色;
(4)数据2无效,取1、3体积进行计算,所用标准液的平均体积为
mL=20.0mL,
HCl~NaOH
1 1
C(HCl)×20.00mL 0.1000mol/L×20.00mL;
C(HCl)=
=0.1000mol/L,故答案为:0.1000;
(5)准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,通过盐酸的体积,根据HCl~NaOH来计算出盐酸的浓度,故答案为:是.
(2)滴定管乙下端是橡皮管,为碱式滴定管,故答案为:乙;
(3)滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中颜色变化,无色变浅红色且半分钟内不褪色,可说明达到滴定终点;故答案为:B;无色变浅红色且半分钟内不褪色;
(4)数据2无效,取1、3体积进行计算,所用标准液的平均体积为
| 21.04-1.02+20.58-0.6 |
| 2 |
HCl~NaOH
1 1
C(HCl)×20.00mL 0.1000mol/L×20.00mL;
C(HCl)=
| 0.1000mol/L×20.00mL |
| 20.00mL |
(5)准确移取20.00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,通过盐酸的体积,根据HCl~NaOH来计算出盐酸的浓度,故答案为:是.
点评:本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及注意事项,把握实验基本操作.

练习册系列答案
相关题目
在一定温度下的刚性密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态( )
| A、混合气体的压强 |
| B、混合气体的体积 |
| C、各气体物质的物质的量浓度 |
| D、气体的总物质的量 |
有关纯碱和小苏打的叙述正确的是( )
| A、等质量的Na2CO3和NaHCO3分别与足量的稀盐酸反应,NaHCO3产生的CO2多 |
| B、等质量的Na2CO3和NaHCO3分别与足量的同种盐酸反应,NaHCO3反应快且消耗的盐酸多 |
| C、向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀 |
| D、Na2CO3和NaHCO3都既能与酸又能与NaOH反应 |
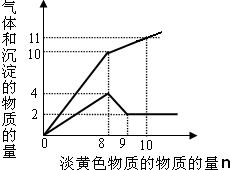 某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是
某溶液中只可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+、Cl-、OH-、CO32-.当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉淀产生,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.该淡黄色物质做焰色反应实验显黄色.可知溶液中含有的离子是