题目内容
表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题:
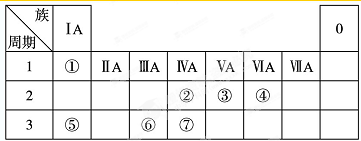
(1)④、⑤、⑥的离子半径由大到小的顺序为 (填离子符号);②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 (填化学式).
(2)工业上,用②的单质在电炉中还原⑦的氧化物得到含有少量杂质的单质⑦,其反应的化学方程式为 .
(3)⑦的最高价氧化物的化学性质不活泼.它是一种酸性氧化物,能与①④⑤组成物质的溶液缓慢反应,请写出其反应的化学方程式 .
(4)⑤、⑥两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 (填序号).
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.比较这两种元素最高价氧化物的水化物的碱性
D.比较这两种元素的气态氢化物的稳定性.

(1)④、⑤、⑥的离子半径由大到小的顺序为
(2)工业上,用②的单质在电炉中还原⑦的氧化物得到含有少量杂质的单质⑦,其反应的化学方程式为
(3)⑦的最高价氧化物的化学性质不活泼.它是一种酸性氧化物,能与①④⑤组成物质的溶液缓慢反应,请写出其反应的化学方程式
(4)⑤、⑥两元素相比较,金属性较强的是
A.将这两种元素的块状单质分别放入冷水中
B.将这两种元素的单质分别和同浓度的盐酸反应
C.比较这两种元素最高价氧化物的水化物的碱性
D.比较这两种元素的气态氢化物的稳定性.
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si.
(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;非金属性越强,最高价含氧酸的酸性越强;
(2)碳与二氧化硅在高温下反应生成Si与CO;
(3)二氧化硅与氢氧化钠反应生成硅酸钠与水;
(4)同周期自左而右金属性减弱,可以根据金属与水或反应的难易程度、剧烈程度以及最高价氧化物对应水化物的碱性强弱判断.
(1)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大;非金属性越强,最高价含氧酸的酸性越强;
(2)碳与二氧化硅在高温下反应生成Si与CO;
(3)二氧化硅与氢氧化钠反应生成硅酸钠与水;
(4)同周期自左而右金属性减弱,可以根据金属与水或反应的难易程度、剧烈程度以及最高价氧化物对应水化物的碱性强弱判断.
解答:
解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si.
(1)O2-、Na+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,同周期左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,故答案为:O2->Na+>Al3+;HNO3>H2CO3>H2SiO3;
(2)碳与二氧化硅在高温下反应生成Si与CO,反应方程式为:2C+SiO2
2 CO↑+Si,故答案为:2C+SiO2
2 CO↑+Si;
(3)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:SiO2+2NaOH═Na2SiO3+H2O,故答案为:SiO2+2NaOH═Na2SiO3+H2O;
(4)同周期自左而右金属性减弱,故金属性Na>Al,可以根据金属与水或反应的难易程度、剧烈程度以及最高价氧化物对应水化物的碱性强弱判断,不能根据金属氢化物稳定性判断,故答案为:Na;ABC.
(1)O2-、Na+、Al3+电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->Na+>Al3+,同周期左而右非金属性增强,同主族自上而下非金属性减弱,非金属性:N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,故答案为:O2->Na+>Al3+;HNO3>H2CO3>H2SiO3;
(2)碳与二氧化硅在高温下反应生成Si与CO,反应方程式为:2C+SiO2
| ||
| ||
(3)二氧化硅与氢氧化钠反应生成硅酸钠与水,反应方程式为:SiO2+2NaOH═Na2SiO3+H2O,故答案为:SiO2+2NaOH═Na2SiO3+H2O;
(4)同周期自左而右金属性减弱,故金属性Na>Al,可以根据金属与水或反应的难易程度、剧烈程度以及最高价氧化物对应水化物的碱性强弱判断,不能根据金属氢化物稳定性判断,故答案为:Na;ABC.
点评:本题考查元素周期表与元素周期律,难度不大,注意掌握微粒半径比较、金属性与非金属性强弱比较及实验事实.

练习册系列答案
相关题目
向紫色石蕊溶液中加入过量Na2O2粉末,振荡,正确的叙述是( )
| A、最后溶液变蓝色 |
| B、溶液先变蓝色最后褪色 |
| C、溶液仍为紫色 |
| D、因为Na2O2与石蕊发生氧化还原反应而无气泡产生 |
在1-18号元素中(稀有气体元素除外),能形成最稳定气态氢化物的元素是 ;与水或酸反应最剧烈的金属单质是 ;最高价氧化物的水化物中碱性最强是 ;最高价氧化物的水化物中酸性最强是 .(全部填写元素符号)
1LNaOH溶液中溶有40g NaOH,则此溶液的物质的量浓度为( )
| A、2mol?L-1 |
| B、1mol?L-1 |
| C、0.5mol?L-1 |
| D、0.05mol?L-1 |
下列说法中,正确的是( )
| A、SiO2和CO2均由分子直接构成 |
| B、CO2、SiO2都是酸性氧化物,不与任何酸反应 |
| C、CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 |
| D、CO2、SiO2分别是H2CO3、H2SiO3的酸酐,因而均可由CO2、SiO2与水反应制得相应酸 |
