题目内容
19.已知可逆反应:A(g)+B(g)?C(g)+D(g)△H<0.请回答下列问题:(1)在某温度下,反应物的起始浓度分别为:c(A)=1mol•L-1,c(B)=2.4mol•L-1,达到 平衡时,A 的转化率为 60%,此时 B 的转化率为25%.
(2)若反应温度降低,则 B 的转化率将增大(填“增大”、“减小”或“不变”).
(3)若反应温度不变,反应物的起始浓度分别为 c(A)=4mol•L-1,c(B)=a mol•L-1,达 到平衡后 c(C)=2mol•L-1,则 a=6.
(4)若反应温度不变,反应物的起始浓度分别为 c(A)=c(B)=b mol•L-1,达到平衡后c(D)=0.4b.($\sqrt{2}$≈0.41保留两位有效数字)
分析 (1)根据方程式可知反应消耗的A和B的物质的量相等进行计算;
(2)根据温度对平衡的影响分析,反应放热,降低温度平衡右移;
(3)由于温度不变,则平衡常数不变,与(1)相同,以此计算;
(4)设平衡时转化的M为xmol,由于温度不变,则平衡常数不变,与(1)相同,以此计算.
解答 解:(1)A转化的浓度为1mol/L×50%=0.5moL/L,则有:
A(g)+B(g)?C(g)+D(g);△H<0
初始:1mol/L 2.4mol/L 0 0
转化:0.6mol/L 0.6mol/L 0.6mol/L 0.6mol/L
平衡:0.4mol/L 1.8mol/L 0.6mol/L 0.6mol/L
B的转化率=$\frac{0.6mol/L}{2.4mol/L}$=25%,
故答案为:25%;
(2)反应放热,降低温度平衡右移,则B的转化率增大,故答案为:增大;
(3)根据相同温度时平衡常数不变求解,
A(g)+B(g)?C(g)+D(g);△H<0
初始:4mol/L amol/L 0 0
转化:2mol/L 2mol/L 2mol/L 2mol/L
平衡:2 mol/L (a-2)mol/L 2mol/L 2mol/L
由于温度不变,则平衡常数不变,与(1)相同,则有:$\frac{0.6mol/L×0.6mol/L}{0.4mol/L×1.8mol/L}$=$\frac{2mol/L×2mol/L}{2mol/L×(a-2)mol/L}$,解之得a=6,故答案为:6;
(4)设平衡时转化的M为xmol,
A(g)+B(g)?C(g)+D(g);△H<0
初始:bmol/L bmol/L 0 0
转化:xmol/L xmol/L xmol/L xmol/L
平衡:(b-x) mol/L (b-x)mol/L xmol/L xmol/L
由于温度不变,则平衡常数不变,与(1)相同,则有:$\frac{{x}^{2}}{(b-x)^{2}}$=$\frac{0.6mol/L×0.6mol/L}{0.4mol/L×1.8mol/L}$,则:x≈0.4b,故答案为:0.4b.
点评 本题考查化学平衡的计算,题目难度不大,做题时注意利用平衡常数计算.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | 氯化铵 | B. | 硫酸 | C. | 食盐 | D. | 氧化钠 |
| A. | 淀粉和淀粉酶混合后微热 | |
| B. | 用蘸有质量分数为75%的酒精棉花球擦皮肤 | |
| C. | 用紫外线光灯照射病房 | |
| D. | 用福尔马林浸动物标本 |
| A. | 加入催化剂可以提高单位时间氨的产量 | |
| B. | 高压有利于氨的合成反应 | |
| C. | 500℃高温比室温更有利于合成氨的反应 | |
| D. | 恒温恒容下,在合成氨平衡体系中充入He,使压强增大,则平衡正向移动,NH3增多 |
C(s)+O2(g)═CO2(g)△H=-Q2 kJ•mol-1;
S(s)+O2(g)═SO2(g)△H=-Q3 kJ•mol-1.
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为( )
| A. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2Q1-2Q2+Q3) kJ•mol-1 | |
| B. | S(s)+2CO(g)═SO2(g)+2C(s)△H=(Q1-Q3) kJ•mol-1 | |
| C. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(Q1-2Q2+Q3) kJ•mol-1 | |
| D. | SO2(g)+2CO(g)═S(s)+2CO2(g)△H=(2Q1-Q2+2Q3) kJ•mol-1 |
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(2)计算此反应在800°C时的化学平衡常数k=0.429
(3)若向平衡后的体系中加入CO和CO2各0.05mol,则此时V(正)<V(逆)
(4)用来还原CuO的CO可以用C和水蒸气反应制得.
已知:C(s)+O2(g)=CO2(g)△H=-393.5kJ/mol
2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ/mol
则C(s)+H2O(g)?CO(g)+H2(g)△H=+175.3kj/mol.
 请完成下列问题
请完成下列问题(1)已知红磷比白磷稳定,则反应
P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(红磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的关系是△H1<△H2(填“>”、“<”)
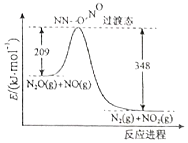
(2)由N2O和NO反应生成1mol N2和NO2的能量变化如图所示,请写出该反应的热化学方程式N2O(g)+NO(g)=N2(g)+NO2(g)△H=-139kJ•moL-1
(3)在298K、101kPa时,已知:
①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3,
则△H3与△H1和△H2之间的关系正确的是A.
A.△H3=△H1+2△H2B.△H3=△H1+△H2
C.△H3=△H1-2△H2D.△H3=△H1-△H2
(4)已知H2(g)+Br2(g)═2HBr(g)△H=-72kJ?mol-1,相关键能数据如表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |