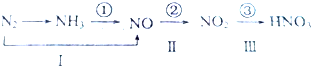题目内容
6.常温下,将10mL0.1mol•L-1的醋酸溶液稀释到100mL,稀释过程中,下列数值逐渐减小的是( )| A. | c(H+)•c(OH-) | B. | $\frac{c{({CH}_{3}COO}^{-})•c{(H}^{+})}{c({CH}_{3}COOH)}$ | ||
| C. | $\frac{c{(H}^{+})}{c({CH}_{3}COOH)}$ | D. | $\frac{c({CH}_{3}C{OO}^{-})}{c{(OH}^{-})}$ |
分析 醋酸是弱电解质,加水稀释促进其电离,所以溶液中n(CH3COOH)减小、n(H+)和n(CH3COO-)增大,但醋酸电离增大程度小于溶液体积增大程度,所以稀释过程中c(H+)减小,温度不变水的离子积常数不变,则c(OH-)增大,据此分析解答.
解答 解:A.温度不变,水的离子积常数不变,所以c(H+)•c(OH-)不变,故A错误;
B.温度不变,电离平衡常数不变,所以$\frac{c{({CH}_{3}COO}^{-})•c{(H}^{+})}{c({CH}_{3}COOH)}$不变,故B错误;
C.加水稀释促进其电离,所以溶液中n(CH3COOH)减小、n(H+)和n(CH3COO-)增大,稀释后溶液体积相同,所以$\frac{c{(H}^{+})}{c({CH}_{3}COOH)}$增大,故C错误;
D.加水稀释促进醋酸电离,则c(CH3COOH)减小,温度不变,水的离子积常数、醋酸电离平衡常数不变,所以$\frac{c({CH}_{3}C{OO}^{-})}{c{(OH}^{-})}$=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+}).c(C{H}_{3}COOH)}{c(C{H}_{3}COOH).c(O{H}^{-}).c({H}^{+})}$=Ka.$\frac{c(C{H}_{3}COOH)}{{K}_{w}}$减小,故D正确;
故选D.
点评 本题考查弱电解质的电离,为高频考点,明确加水稀释醋酸溶液中各微粒浓度变化是解本题关键,易错选项是D,注意等量变换,题目难度中等.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
16.目前,一种人称“摇摇冰”的即冷即饮型饮料开始上市.所谓“摇摇冰”是指吸食前将饮料罐隔离层中的制冷物质和水混合摇动能使罐中饮料冷却.请根据所学知识猜测该制冷物质是( )
| A. | 固体硝酸铵 | B. | 氯化钠 | C. | 生石灰 | D. | 固体氢氧化钠 |
1.如果将20mL 12mol•L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将( )
| A. | ≥1.68L | B. | >1.68L | C. | ≤1.68L | D. | <1.68L |
11.下列各组离子,在同一溶液中能大量共存的是( )
| A. | Ca2+、Na+、Cl-、NO${\;}_{3}^{-}$ | B. | H+、Na+、Cl-、CO32- | ||
| C. | Na+、Ag+、Cl-、OH- | D. | Na+、Ca2+、Cl-、CO32- |
18.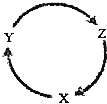 下列各组物质中,不能满足如图物质一步转化关系的选项是( )
下列各组物质中,不能满足如图物质一步转化关系的选项是( )
 下列各组物质中,不能满足如图物质一步转化关系的选项是( )
下列各组物质中,不能满足如图物质一步转化关系的选项是( ) | 选项 | X | Y | Z |
| A | Fe | FeCl3 | FeCl2 |
| B | Al(OH)3 | AlCl3 | Al2O3 |
| C | SiO2 | Na2SiO3 | H2SiO3 |
| D | NH3 | NH4Cl | NH4NO3 |
| A. | A | B. | B | C. | C | D. | D |
11.将0.2mol•L-1HCOOH溶液加水稀释,下列说法正确的是( )
| A. | 溶液中c(H+)和c(OH-)都减小 | B. | 溶液中c(H+)增大 | ||
| C. | 醋酸电离平衡向左移动 | D. | 溶液的pH增大 |