题目内容
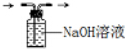
1.如果将20mL 12mol•L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将( )| A. | ≥1.68L | B. | >1.68L | C. | ≤1.68L | D. | <1.68L |
分析 若HCl完全反应,由2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O计算生成氯气体积,但随反应进行,浓盐酸转化为稀盐酸,不再发生氧化还原反应.
解答 解:20ml 12mol•L-1的浓盐酸与足量KMnO4充分反应,n(HCl)=0.02L×12mol/L=0.24mol,若完全反应生成氯气为0.24mol×$\frac{5}{16}$=0.075mol,其体积为0.075mol×22.4L/mol=1.68L,但随反应进行,浓盐酸变为稀盐酸,不再发生氧化还原反应,则产生氯气小于1.68L,
故选D
点评 本题考查氧化还原反应、化学方程式计算等,关键是明确稀盐酸不与高锰酸钾反应,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
11.下列说法中,正确的是( )
| A. | 在化学反应过程中,发生物质变化的同时不一定发生能量变化 | |
| B. | 生成物所具有的总键能大于反应物所具有的总键能时,反应为吸热反应 | |
| C. | 生成物的总能量大于反应物的总能量时,△H>0 | |
| D. | △H的大小与热化学方程式的化学计量数无关 |
9.某温度下,在一定体积的密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如下表,下列说法错误的是( )
| 物质 | X | Y | Z | W |
| 初始浓度/mol•L-1 | 0.5 | 0.6 | 0 | 0 |
| 平衡浓度/mol•L-1 | 0.1 | 0.1 | 0.4 | 0.6 |
| A. | 增大压强反应的平衡常数不变,但X的转化率增大 | |
| B. | 该反应的化学方程式为:4X (g)+5Y (g)?4Z (g)+6W (g) | |
| C. | 反应达到平衡时,X的转化率为80% | |
| D. | 其它条件不变,若增大Y的起始浓度,X的转化率增大 |
6.常温下,将10mL0.1mol•L-1的醋酸溶液稀释到100mL,稀释过程中,下列数值逐渐减小的是( )
| A. | c(H+)•c(OH-) | B. | $\frac{c{({CH}_{3}COO}^{-})•c{(H}^{+})}{c({CH}_{3}COOH)}$ | ||
| C. | $\frac{c{(H}^{+})}{c({CH}_{3}COOH)}$ | D. | $\frac{c({CH}_{3}C{OO}^{-})}{c{(OH}^{-})}$ |
13.在高温和催化剂的作用下,向容积为2L的密闭容器加入0.2mol的CO和0.2mol的H2O,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H=a kJ/mol(a>0).达到平衡后,测得c(CO):c(CO2)=3:2.下列说法正确的是( )
| A. | 反应放出的热量为0.2akJ | |
| B. | 平衡时H2O的转化率为60% | |
| C. | 升高温度,v(正)加快v(逆)减慢,平衡正向移动 | |
| D. | 将容器的体积压缩为1L,H2的体积分数变为60% |

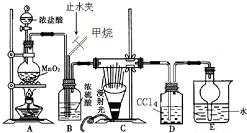 利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图:
利用甲烷与氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组拟在实验室中模拟上述过程,其设计的模拟装置如图: B.
B. C.
C.